选择题 25℃时,0.1mol/L下列溶液的pH如下表,有关比较错误的是
序 号
| ①
| ②
| ③
| ④
|
溶液
| NaCl
| CH3COONH4
| NaF
| NaHCO3
|
pH
| 7.0
| 7.0
| 8.1
| 8.4
|
A.酸的强度:HF>H2CO3
B.由水电离产生的c(H+):①=②
C.溶液中离子的总浓度:①>③
D.④溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)
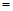
0.1 mol/L
选择题 25℃时,0.1mol/L下列溶液的pH如下表,有关比较错误的是
序 号
| ①
| ②
| ③
| ④
|
溶液
| NaCl
| CH3COONH4
| NaF
| NaHCO3
|
pH
| 7.0
| 7.0
| 8.1
| 8.4
|
A.酸的强度:HF>H2CO3
B.由水电离产生的c(H+):①=②
C.溶液中离子的总浓度:①>③
D.④溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)
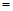
0.1 mol/L
本题答案:B
本题解析:
试题分析:A.酸越弱,其酸根离子水解程度就越大,溶液的碱性就越强。由于0.1mol0.1mol/L NaF溶液的pH=8.1,NaHCO3溶液的pH=8.4,所以酸性HF> H2CO3,正确;B.NaCl是强酸强碱盐,盐电离产生的离子不能发生水解反应,所以对水的电离平衡不产生影响,CH3COONH4是弱酸弱碱盐,盐电离产生的阳离子和阴离子都发生水解反应,消耗水电离产生的H+、OH-,促进水的电离,使水的电离程度增大,所以由水电离产生的c(H+):①<②,错误;C.NaCl是强酸强碱盐,不发生水解,根据电荷守恒可得c(Na+)+c(H+)=c(Cl-)+c(OH-),而NaF是强碱弱酸盐,F-发生水解反应消耗,所以c(Cl-)>c(F-),F-发生水解反应消耗水电离产生的H+,使溶液显碱性,所以c(H+)前者大于后者,因此离子总浓度
91ExAm.org:前者大于后者,①>③,正确;D.④溶液中,根据物料守恒可得:c(HCO3-)+c(CO32-)+c(H2CO3)=" 0.1" mol/L,正确。
考点:考查盐水解平衡常数的应用、盐溶液对水电离平衡的影响、溶液中离子定向比较的知识。
本题所属考点:【盐类水解的原理】
本题难易程度:【一般】
Learning is the eye of the mind. 知识是心灵的慧眼.
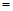 0.1 mol/L
0.1 mol/L 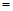 0.1 mol/L
0.1 mol/L