时间:2016-12-25 16:57:31
填空题 (8分)(1)FeCl3的水溶液呈 (“酸”、“中”、“碱”)性,常温时的pH ; 7(填“>”、“=”、“<”),原因是(用离子方程式表示): 。
(2)实验室在配制 FeCl3的溶液时,常将FeCl3固体先溶于 中,然后再用蒸馏水稀释到所需的浓度。
(3)把FeCl3溶液蒸干,灼烧,最后得到的主要产物是 。
(4)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒中盛碳酸氢钠溶液,其化学反应的原理是(用离子方程式解释) 。碳酸氢钠溶液中的电荷守恒式为 ,溶液中离子浓度由大到小的顺序为 。
填空题 (8分)(1)FeCl3的水溶液呈 (“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): 。
(2)实验室在配制 FeCl3的溶液时,常将FeCl3固体先溶于 中,然后再用蒸馏水稀释到所需的浓度。
(3)把FeCl3溶液蒸干,灼烧,最后得到的主要产物是 。
(4)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒中盛碳酸氢钠溶液,其化学反应的原理是(用离子方程式解释) 。碳酸氢钠溶液中的电荷守恒式为 ,溶液中离子浓度由大到小的顺序为 &# 160; 。
本题答案:(1)酸,< ,Fe 3+ +3 H2O 本题解析:
试题分析:(1)(1)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe3++3H2O?Fe(OH)3+2H+,所以其溶液pH<7;(2)在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,从而抑制氯化铁水解;(3)氯化铁水解水:Fe3++ 3H2O Fe(OH)3+ 3H+,把FeCl3溶液蒸干,灼烧,Fe(OH)3分解最后得到的主要固体产物是:Fe2O3;(4)Al3+水解溶液呈酸性,而
Fe(OH)3+ 3H+,把FeCl3溶液蒸干,灼烧,Fe(OH)3分解最后得到的主要固体产物是:Fe2O3;(4)Al3+水解溶液呈酸性,而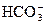 水解溶液呈碱性,相互促进,合并两水解反应方程式即得:Al3++3HCO3-===Al(OH)3↓+3CO2↑;碳酸氢钠在溶液中既存在电离平衡,也存在水解平衡,所以NaHCO3在水溶液中所发生的电离与水解反应的离子方程式有NaHCO3= Na++ HCO3- 、HCO3-
水解溶液呈碱性,相互促进,合并两水解反应方程式即得:Al3++3HCO3-===Al(OH)3↓+3CO2↑;碳酸氢钠在溶液中既存在电离平衡,也存在水解平衡,所以NaHCO3在水溶液中所发生的电离与水解反应的离子方程式有NaHCO3= Na++ HCO3- 、HCO3- H++ CO32-、HCO3-+ H2O
H++ CO32-、HCO3-+ H2O OH-+ H2CO3;其电荷守恒的表达式是c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-) + c(OH-) ;首先,溶液显碱性,OH->H+,且H+认为是最少的其次,NaHCO3="Na+" + HCO3-,HCO3-
OH-+ H2CO3;其电荷守恒的表达式是c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-) + c(OH-) ;首先,溶液显碱性,OH->H+,且H+认为是最少的其次,NaHCO3="Na+" + HCO3-,HCO3- H+ + CO32-,即第二步电离,可逆HCO3-+ H2O
H+ + CO32-,即第二步电离,可逆HCO3-+ H2O  H2CO3 + OH-,水解程度略大于电离程度,所以溶液显碱性另外,还存在H2O的电离,H2O
H2CO3 + OH-,水解程度略大于电离程度,所以溶液显碱性另外,还存在H2O的电离,H2O H+ + OH- ,由于HCO3-既有电离的,也有水解的,所以,Na+> HCO3-,由于HCO3-的电离和水解程度都是比较小的,所以,Na+> HCO3->OH->H+ 由于,OH-来自两步反应,HCO3-的水解和H2O的电离,所以比CO32-要多因此,c(Na+)> c(HCO3-) > c(OH-) > c(CO32-)> c(H+)。
H+ + OH- ,由于HCO3-既有电离的,也有水解的,所以,Na+> HCO3-,由于HCO3-的电离和水解程度都是比较小的,所以,Na+> HCO3->OH->H+ 由于,OH-来自两步反应,HCO3-的水解和H2O的电离,所以比CO32-要多因此,c(Na+)> c(HCO3-) > c(OH-) > c(CO32-)> c(H+)。
考点:考查盐类水解的应用,影响盐类水解程度的主要因素。
本题所属考点:【盐类水解的原理】
本题难易程度:【一般】