时间:2016-12-25 16:36:14
填空题 (选做)现有浓度均为0.1 mol/L的下列溶液:①硫酸.②醋酸.③氢氧化钠.④氯化铵.⑤醋酸铵.⑥硫酸铵.⑦硫酸氢铵.⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)________________.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)________________.
(3)将③和④等体积混合后,溶液中各离子浓度由大到小的顺序是______ .
(4)已知t℃时,KW=1×10-13,则t℃(填“>”.“<” 91EXAm.org或“=”)______25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b________.
填空题 (选做)现有浓度均为0.1 mol/L的下列溶液:①硫酸.②醋酸.③氢氧化钠.④氯化铵.⑤醋酸铵.⑥硫酸铵.⑦硫酸氢铵.⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)________________.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)________________.
(3)将③和④等体积混合后,溶液中各离子浓度由大到小的顺序是______ .
(4)已知t℃时,KW=1×10-13,则t℃(填“>”.“<”或“=”)______25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b________.
本题答案:(1)④②③①;(2)⑥⑦④⑤⑧;(3)c(Na+)=c(C
本题解析:
试题分析:(1)根据水的离子积以及水电离出c(H+)=c(OH-),假设温度是常温下,①0.1mol·L-1H2SO4溶液中的OH-来自水,c(OH-)= 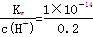 =5×10-14,水电离出的c(H+)=5×10-14,②醋酸是弱酸,产生的H+少,对水电离的抑制弱,③0.1mol/lNaOH溶液中,c(H+)=
=5×10-14,水电离出的c(H+)=5×10-14,②醋酸是弱酸,产生的H+少,对水电离的抑制弱,③0.1mol/lNaOH溶液中,c(H+)= 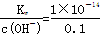 =1×10-13,④NH4Cl是弱碱强酸盐,NH4+水解使溶液显酸性,促进水的电离,因此由水电离出的H+的浓度由大到小的顺序:④②③①;(2)以④为研究对象,考虑对NH4+水解的影响,NH4++H2O
=1×10-13,④NH4Cl是弱碱强酸盐,NH4+水解使溶液显酸性,促进水的电离,因此由水电离出的H+的浓度由大到小的顺序:④②③①;(2)以④为研究对象,考虑对NH4+水解的影响,NH4++H2O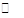 NH3·H2O+H+,⑤相当于向④中加入CH3COO-,CH3COO-+H2O
NH3·H2O+H+,⑤相当于向④中加入CH3COO-,CH3COO-+H2O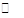 CH3COOH+OH-,互相促进水解,因此⑤中的c(NH4+)小于④中的,⑥盐类的水解是微弱的,1mol(NH4)2SO4中含有2molNH4+,因此⑥中的c(NH4+)大于④中的,是五种物质中最多的,⑦NH4HSO4=NH4++H++SO42-,电离出的H+对NH4+水解起抑制作用,c(NH4+)大于④中的,但小于⑥中的 ,⑧NH3·H2O是弱电解质,弱电解质的电离是微弱的,c(NH4+)是五种物质中最少的,因此c(NH4+)由大到小的顺序:⑥⑦④⑤⑧;(3)NaOH和NH4Cl等体积等浓度混合后,溶液中的溶质:NaCl、NH3·H2O且物质的量相等,NH3·H2O是弱电解质,部分电离,NaCl是强电解质全部电离,反应后的溶液显碱性,离子浓度大小顺序:c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+);(4)水的离子积只受温度的影响,温度升高水的离子积增大,Kw=1×10-13>1×10-14,t℃>25℃,反应后溶液的pH=2,说明溶液呈现酸性,酸过量即:
CH3COOH+OH-,互相促进水解,因此⑤中的c(NH4+)小于④中的,⑥盐类的水解是微弱的,1mol(NH4)2SO4中含有2molNH4+,因此⑥中的c(NH4+)大于④中的,是五种物质中最多的,⑦NH4HSO4=NH4++H++SO42-,电离出的H+对NH4+水解起抑制作用,c(NH4+)大于④中的,但小于⑥中的 ,⑧NH3·H2O是弱电解质,弱电解质的电离是微弱的,c(NH4+)是五种物质中最少的,因此c(NH4+)由大到小的顺序:⑥⑦④⑤⑧;(3)NaOH和NH4Cl等体积等浓度混合后,溶液中的溶质:NaCl、NH3·H2O且物质的量相等,NH3·H2O是弱电解质,部分电离,NaCl是强电解质全部电离,反应后的溶液显碱性,离子浓度大小顺序:c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+);(4)水的离子积只受温度的影响,温度升高水的离子积增大,Kw=1×10-13>1×10-14,t℃>25℃,反应后溶液的pH=2,说明溶液呈现酸性,酸过量即: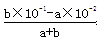 =10-2,解得:a:b=9:2。
=10-2,解得:a:b=9:2。
考点:考查水的离子积的计算、弱电解质的电离、影响盐类水解的因素、pH的计算等相关知识。
本题所属考点:【盐类水解的原理】
本题难易程度:【困难】