时间:2016-12-25 16:20:09
填空题 (16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是
(2)工业上合成氨气的反应为:N2(g) + 3H2(g)  2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(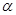 )与体系总压强(P)、温度(T)的关系如图所示。
)与体系总压强(P)、温度(T)的关系如图所示。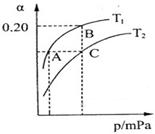
回答下列问题:
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= 。
②平衡状态由A变到C时,对应的平衡常数K(A) K(C)(填“>”、“<”或“=”)。
③平衡状态由A变到B时,对应的平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
| HClO | HSCN | H2CO3 |
| K=3.2×10-8 | K=0.13 | Kl=4.2×10-7 K2=5.6×10-11 |
填空题 (16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是
(2)工业上合成氨气的反应为:N2(g) + 3H2(g)  2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(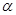 )与体系总压强(P)、温度(T)的关系如图所示。
)与体系总压强(P)、温度(T)的关系如图所示。
回答下列问题:
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= 。
②平衡状态由A变到C时,对应的平衡常数K(A) K(C)(填“>”、“<”或“=”)。
③平衡状态由A变到B时,对应的平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
| HClO | HSCN | H2CO3 |
| K=3.2×10-8 | K=0.13 | Kl=4.2×10-7 K2=5.6×10-11 |
 2NH3(g)
2NH3(g)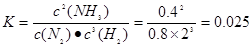 ,故答案为:0.025;
,故答案为:0.025; 2NH3(g)△H<0,正反应为放热反应,降低温度,平衡向正反应方向移动,氮气转化率增大,图象分析判断T1<T2,平衡状态由A变到C时,温度升高平衡常数减小,所以平衡常数K(A)>K(C),平衡状态由A变到B时,温度不变平衡常数不变,所以平衡常数K(A)=K(B);(3)①KSCN溶液中SCN-水解显碱性,溶液中离子浓度大小为c(K+)>c(SCN-)>c(OH-)>c(H+);
2NH3(g)△H<0,正反应为放热反应,降低温度,平衡向正反应方向移动,氮气转化率增大,图象分析判断T1<T2,平衡状态由A变到C时,温度升高平衡常数减小,所以平衡常数K(A)>K(C),平衡状态由A变到B时,温度不变平衡常数不变,所以平衡常数K(A)=K(B);(3)①KSCN溶液中SCN-水解显碱性,溶液中离子浓度大小为c(K+)>c(SCN-)>c(OH-)>c(H+);本题所属考点:【盐类水解的原理】
本题难易程度:【困难】