填空题 (共13分)氯碱工业是最基本的化学工业之一,其主要原理基于电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
(1)电解前,如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是______________(填字母代号)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(2)“盐泥 ”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
成分
| NaCl
| Mg(OH)2
| CaCO3
| BaSO4
| 其他不溶物
|
质量分数(%)
| 15~20
| 15~20
| 5~10
| 30~40
| 10~15
|
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。
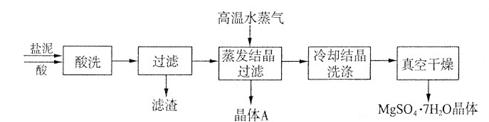
回答下列问题:
①酸洗过程中加入适量硫酸控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,CaCO3在此过程中转化为CaSO4,请解释此转化得以发生的原因_________。
②过滤所得滤渣的主要成分为____________________________。
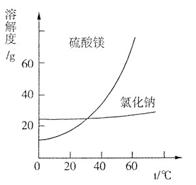
③根据下图分析,蒸发结晶过滤所得晶体A主要成分为____________________。
④真空干燥MgSO4·7H2O晶体的原因是______________________。
(3)已知NaCl在60 ℃的溶解度为37.1 g,现电解60 ℃精制饱和食盐水1371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为________________mol/L。
填空题 (共13分)氯碱工业是最基本的化学工业之一,其主要原理基于电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
(1)电解前,如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是______________(填字母代号)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(2)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
成分
| NaCl
| Mg(OH)2
| CaCO3
| BaSO4
| 其他不溶物
|
质量分数(%)
| 15~20
| 15~20
| 5~10
| 30~40
| 10~15
|
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。

回答下列问题:
①酸洗过程中加入适量硫酸控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,CaCO3在此过程中转化为CaSO4,请解释此转化得以发生的原因_________。
②过滤所得滤渣的主要成分为____________________________。
③根据下图分析,蒸发结晶过滤所得晶体A主要成分为____________________。

④真空干燥MgSO4·7H2O晶体的原因是______________________。
(3)已知NaCl在60 ℃的溶解度为37.1 g,现电解60 ℃精制饱和食盐水1371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为________________mol/L。
本题答案:(1)A、C
(2)①硫酸能与碳酸钙反应,搅拌过程中产
本题解析:
试题分析:(1)电解前,如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,在除去杂质的时候,尽量不要引入新的杂质离子,所以该钡试剂可以是A.Ba(OH)2、C.BaCl2;(2)①酸洗过程中加入适量硫酸控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,CaCO3在此过程中转化为CaSO4,此转化得以发生的原因是硫酸能与碳酸钙反应,搅拌过程中产生的CO2不断逸出,碳酸钙转化为硫酸钙;②过滤所得滤渣的主要成分为BaSO4、CaSO4等不溶于酸的物质;③根据物质的溶解度与温度的关系可知:NaCl的溶解度受温度的影响变化较小,而MgSO的溶解度受温度的影响变化较大,所以不断蒸发溶剂,MgSO4就会变为饱和溶液,再蒸发,就会析出晶体,得到的滤液主要成分是NaCl.因此最后蒸发溶剂得到的晶体主要是NaCl;④真空干燥MgSO4·7H2O晶体的原因是减小压强,降低水的沸点,避免干燥温度过高而失去结晶水(3)由于NaCl在60 ℃的溶解度为37.1 g,所以电解60 ℃精制饱和食盐水1371 g,则其中含有NaCl371g,H2O是1000g。经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解的NaCl的质量是371g-20 g=351g,根据电解的方程式是:2NaCl+2H2O

2NaOH+H2↑+Cl2↑,可知每反应消耗117gNaCl就会产生2mol的NaOH,其质量是80g,放出氢气和氯气各1mol,现在反应了NaCl是351g,则产生的NaOH的物质的量是(351g÷117g)×2mol=6mol,放出氢气与氯气的物质的量都是3mol,所以反应后溶液的质量是1371 g-3mol×2 g/mol-3mol×71g/mol=1152g,所以溶液的体积是:1152g÷1.37 g·cm-3=840.9ml=0.8409L,所以电解后NaOH的物质的量浓度为c=n÷V=6mol÷="0.8409L" =7.14mol/L。
考点:考查粗盐的除杂与提纯、混合物的分离、食盐水的电解一产物的物质的量浓度的计算的知识。
本题所属考点:【电解池原理】
本题难易程度:【一般】
Every tub must stand on its own bottom. 人须自立.
 2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:

 2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:

 2NaOH+H2↑+Cl2↑,可知每反应消耗117gNaCl就会产生2mol的NaOH,其质量是80g,放出氢气和氯气各1mol,现在反应了NaCl是351g,则产生的NaOH的物质的量是(351g÷117g)×2mol=6mol,放出氢气与氯气的物质的量都是3mol,所以反应后溶液的质量是1371 g-3mol×2 g/mol-3mol×71g/mol=1152g,所以溶液的体积是:1152g÷1.37 g·cm-3=840.9ml=0.8409L,所以电解后NaOH的物质的量浓度为c=n÷V=6mol÷="0.8409L" =7.14mol/L。
2NaOH+H2↑+Cl2↑,可知每反应消耗117gNaCl就会产生2mol的NaOH,其质量是80g,放出氢气和氯气各1mol,现在反应了NaCl是351g,则产生的NaOH的物质的量是(351g÷117g)×2mol=6mol,放出氢气与氯气的物质的量都是3mol,所以反应后溶液的质量是1371 g-3mol×2 g/mol-3mol×71g/mol=1152g,所以溶液的体积是:1152g÷1.37 g·cm-3=840.9ml=0.8409L,所以电解后NaOH的物质的量浓度为c=n÷V=6mol÷="0.8409L" =7.14mol/L。