时间:2016-12-24 00:30:15
实验题 NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图: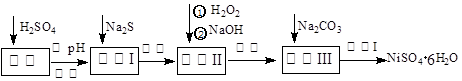
请回答下列问题:
(1)溶解废渣常用一定浓度的稀硫酸,用浓硫酸配制一定浓度的稀硫酸用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式: 。
(3)在40℃左右,用6%的H2O2氧化Fe2+,再在95℃时加入NaOH调节pH,除去铁和铬。此外,除去铁还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp = 2.64×10?39)。下列说法正确的是______(选填序号)。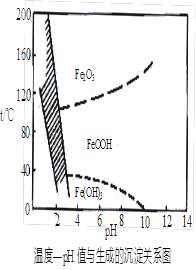
a.FeOOH中铁为+2价
b.来源:91考试网 91exam.org若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10?27
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是_________________。
(5)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是 。
(6)操作Ⅰ的实验步骤依次为:【实验中可选用的试剂:6mol?L-1的H2SO4溶液,蒸馏水、pH试纸】。
①__________________________________;
②__________________________________;
③ ;
④用少量乙醇洗涤NiSO4?6H2O晶体并晾干。
实验题 NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图: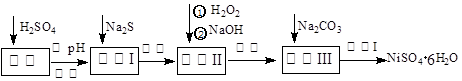
请回答下列问题:
(1)溶解废渣常用一定浓度的稀硫酸,用浓硫酸配制一定浓度的稀硫酸用到的玻璃仪器除烧杯、量筒、玻璃棒外还有: 。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式: 。
(3)在40℃左右,用6%的H2O2氧化Fe2+,再在95℃时加入NaOH调节pH,除去铁和铬。此外,除去铁还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp = 2.64×10?39)。下列说法正确的是______(选填序号)。
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10?27
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是_________________。
(5)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是 。
(6)操作Ⅰ的实验步骤依次为:【实验中可选用的试剂:6mol?L-1的H2SO4溶液,蒸馏水、pH试纸】。
①__________________________________;
②_________________________________来源:91考试网 91exam.org_;
③ ;
④用少量乙醇洗涤NiSO4?6H2O晶体并晾干。
本题答案:(1)容量瓶 胶头滴管
(2)S2-+Cu2+= Cu
本题解析:
试题分析:(1)用浓硫酸配制一定物质的量浓度的稀硫酸用到的玻璃仪器除烧杯、量筒、玻璃棒外还有容量瓶 胶头滴管;(2)Na2S是可溶性盐,溶于水时电离出S2ˉ,S2ˉ与Cu2+易反应生成CuS沉淀,离子方程式为S2-+Cu2+= CuS↓;(3)a.FeOOH中铁为+3价,错误;b.根据25℃时Fe(OH)3的Ksp = c(Fe3+) c3(OH-) =2.64×10?39,pH=4时,c(OH-) =10?10除去铁,此时溶液中c(Fe3+)=2.64×10?9,错误;c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,正确;d.分析图像知,工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8,正确;选cd;(4)分析流程图知,加Na2S的目的是除去铜、锌等杂质,加H2O2、NaOH的目的是除去铁等杂质,加Na2CO3的目的是除去铬等杂质,因此推断滤液1的主要成分是NiSO4、FeSO4、Cr2(SO4)3、Na2SO4,滤液II的主要成分是NiSO4、Cr2(SO4)3、Na2SO4,滤液III的主要成分是NiSO4、Na2SO4;(5)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是上层清液呈无色(6)从NiSO4、Na2SO4及硫酸的混合溶液中制取NiSO4?6H2O晶体,需要蒸发浓缩、冷却结晶并从溶液中分离出晶体。
考点:考查化学工艺流程、物质的制备。
本题所属考点:【电解池原理】
本题难易程度:【困难】