时间:2016-12-24 00:12:02
填空题 如图表示各物质之间的转化关系。已知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。
(1)写出X的电子式: 。
(2)常温时pH =12的G溶液中,溶质的阳离子与溶质的阴离子浓度之差为 (写出计算式)。
(3)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则铜是____极,请写出在E电极上发生的电极反应式: 。
(4)写出反应③的离子方程式: 。
(5)现有无标签的Y和M的两种无色水溶液,不用其他任何试剂,请你设计一个简单的实验对这两种溶液加以鉴别 (回答实验操作、现象及结论)。
(6)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp =2.097×l0-39。将0.01 mol/L的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,你认为能否形成沉淀____(填“能”或“不能”),请通过计算说明 。
填空题 如图表示各物质之间的转化关系。已知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。
(1)写出X的电子式: 。
(2)常温时pH =12的G溶液中,溶质的阳离子与溶质的阴离子浓度之差为 (写出计算式)。
(3)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则铜是____极,请写出在E电极上发生的电极反应式: 。
(4)写出反应③的离子方程式: 。
(5)现有无标签的Y和M的两种无色水溶液,不用其他任何试剂,请你设计一个简单的实验对这两种溶液加以鉴别 (回答实验操作、现象及结论)。
(6)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp =2.097×l0-39。将0.01 mol/L的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,你认为能否形成沉淀____(填“能”或“不能”),请通过计算说明 。
本题答案:(1)。(2)若溶液的pH =12是由盐水解产生的。则根据NaAlO2=Na++AlO2-。AlO2-+2H2O
 Al(OH)3+OH-. pH=12,c(OH-)=10-12mol/L所以c(Na+)-c(AlO2-)= 10-12mol/L。若溶液的碱性是有NaOH电离产生,则NaOH= Na++ OH-和NaAlO2=Na++AlO2-可得:c(Na+)=c(AlO2-)+10-12mol/L,所以 c(Na+)-c(AlO2-)= 10-2mol/L。因此该溶液中溶质的阳离子与溶质的阴离子浓度之差为10-2~10-12mol/L。(3)电镀时,镀件作阴极,镀层金属作阳极,含有镀层金属离子的溶液作电解质溶液。所以Cu作阳极。镀件Fe上发生的反应为Cu2++2e-=Cu。(4)反应③为Al与强碱溶液发生的反应,其的离子方程式2Al+2OH-+ 2H2O =2AlO2-+3H2↑。(5)因为Al(OH)3为两性氢氧化物,能与强碱发生反应而溶解。但是不能溶解在AlCl3溶液中。所以可以通过相互滴加时不同的实验现象加以区分。两种溶液各取少量,将其中的一个溶液滴加到另一种溶液中,若马上就有沉淀,则被滴加的为AlCl3溶液,滴加的为NaOH溶液;若开始无现象,后来才有沉淀产生,则被滴加的为NaOH溶液,滴加的为AlCl3溶液。(6) 由题意知Ksp(Fe(OH)3) =2.097×l0-39.将0.01 mol/L的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,则c(Fe3+)=
Al(OH)3+OH-. pH=12,c(OH-)=10-12mol/L所以c(Na+)-c(AlO2-)= 10-12mol/L。若溶液的碱性是有NaOH电离产生,则NaOH= Na++ OH-和NaAlO2=Na++AlO2-可得:c(Na+)=c(AlO2-)+10-12mol/L,所以 c(Na+)-c(AlO2-)= 10-2mol/L。因此该溶液中溶质的阳离子与溶质的阴离子浓度之差为10-2~10-12mol/L。(3)电镀时,镀件作阴极,镀层金属作阳极,含有镀层金属离子的溶液作电解质溶液。所以Cu作阳极。镀件Fe上发生的反应为Cu2++2e-=Cu。(4)反应③为Al与强碱溶液发生的反应,其的离子方程式2Al+2OH-+ 2H2O =2AlO2-+3H2↑。(5)因为Al(OH)3为两性氢氧化物,能与强碱发生反应而溶解。但是不能溶解在AlCl3溶液中。所以可以通过相互滴加时不同的实验现象加以区分。两种溶液各取少量,将其中的一个溶液滴加到另一种溶液中,若马上就有沉淀,则被滴加的为AlCl3溶液,滴加的为NaOH溶液;若开始无现象,后来才有沉淀产生,则被滴加的为NaOH溶液,滴加的为AlCl3溶液。(6) 由题意知Ksp(Fe(OH)3) =2.097×l0-39.将0.01 mol/L的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,则c(Fe3+)= 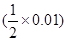 mol/L,c(OH-)=
mol/L,c(OH-)=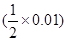 mol/L, c(Fe3+)·c3(OH-) =
mol/L, c(Fe3+)·c3(OH-) =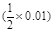 ×
× 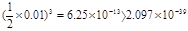 ,所以能生成Fe(OH)3沉淀。
,所以能生成Fe(OH)3沉淀。
考点:考查元素的推断、电子式、离子方程式、化学方程式的书写、物质的鉴别、电镀原理的应用、沉淀的形成等知识。
本题所属考点:【电解池原理】
本题难易程度:【困难】