时间:2016-12-18 21:19:21
选择题 已知100℃时,0.01mol·L-1 NaHSO4溶液中水电离的c(H+)=10-10 mol·L-1,该温度下将pH=8的Ba(OH)2溶液V1 L与pH=5 V2 L NaHSO4混合,所得溶液pH=7,则 V1∶V2=
A.2∶9
B.1∶9
C .1∶1
D.1∶2
选择题 已知100℃时,0.01mol·L-1 NaHSO4溶液中水电离的c(H+)=10-10 mol·L-1,该温度下将pH=8的Ba(OH)2溶液V1 L与pH=5 V2 L NaHSO4混合,所得溶液pH=7,则 V1∶V2=
A.2∶9
B.1∶9
C.1∶1
D.1∶2
本题答案:A
本题解析:0.01mol·L-1 NaHSO4溶液中水电离的c(H+)=10-10 mol·L-1,说明溶液中OH-的浓度也是10-10 mol·L-1,氢离子浓度是0.01mol/L,所以该温度下水的离子积常数为1×10-12。所得溶液pH=7,说明溶液显碱性,即碱是过量的,所以有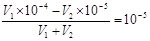 ,解得V1∶V2=2∶9,答案选A。
,解得V1∶V2=2∶9,答案选A。
本题所属考点:【溶液的性质及计算】
本题难易程度:【简单】