时间:2016-12-18 19:40:06
选择题 常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1某一元弱酸HA溶液滴定曲线如图。下列说法正确的是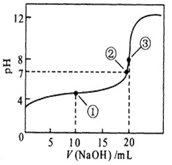
A.点①所示溶液中:c(A-)+c(OH-) =c(HA) +c(H+ )
B.点②所示溶液中:c(Na+) = c(HA) +c(A-)
C.点③所示溶液中:c(Na+) > c(A-)> c(OH-) > c(H+)
D.滴定过程中可能出现:c(HA) > c(A-) > c(H+) > c(OH-)> c(Na+)
选择题 常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1某一元弱酸HA溶液滴定曲线如图。下列说法正确的是
A.点①所示溶液中:c(A-)+c(OH-) =c(HA) +c(H+)
B.点②所示溶液中:c(Na+) = c(HA) +c(A-)
C.点③所示溶液中:c(Na+) > c(A-)> c(OH-) > c(H+)
D.滴定过程中可能出现:c(HA) > c(A-) > c(H+) > c(OH-)> c(Na+)
本题答案:C
本题解析:本题主要考查的是粒子浓度大小的比较。A项,处于点①时,酸过量,根据电荷守恒,则有c(H+)=c(OH-)+c(A-);B项,在点②时,pH=7,仍没有完全反应,算过量,c(Na+)<c(A-)+c(HA);C项,当V(NaOH)=20.00ml时,两者完全反应,此时由于HA-的水解,溶液呈碱性,但水解程度是微弱的,c(Na+)>c(A-)>c(OH-)>c(H+),正确;D项,在滴定过程中,当NaOH的量少时,不能完全中和醋酸,则有c(HA) > c(A-) > c(H+) > c(Na)> c(OH-)+)?,故D错误。 综上分析可知,本题选C项。
本题所属考点:【化学基本理论】
本题难易程度:【简单】