时间:2016-12-18 16:42:45
选择题 在Al2(SO4)3、K2SO4和明矾的混和溶液中,如果c(SO42-)等于0.2mol/L,当加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解, 则原混和液中K+的物质的浓度为
A.0.2mol/L
B.0.25mol/L
C.0.45mol/L
D.0.225mol/L
选择题 在Al2(SO4)3、K2SO4和明矾的混和溶液中,如果c(SO42-)等于0.2mol/L,当加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,则原混和液中K+的物质的浓度为
A.0.2mol/L
B.0.25mol/L
C.0.45mol/L
D.0.225mol/L
本题答案:C
本题解析:分析:Al2(SO4)3、K2SO4和明矾的混和溶液中,加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,根据硫酸根守恒,此时溶液中c(SO42-)= ×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)=
×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)=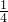 ×0.2mol/L×
×0.2mol/L× =0.025mol/L,由电荷守恒可知此时 91eXAm.org溶液中c(K+)=c(AlO2-)+2c(SO42-),原混合溶液中为反应后溶液中c(K+)的二倍.
=0.025mol/L,由电荷守恒可知此时 91eXAm.org溶液中c(K+)=c(AlO2-)+2c(SO42-),原混合溶液中为反应后溶液中c(K+)的二倍.
解答:Al2(SO4)3、K2SO4和明矾的混和溶液中,加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,根据硫酸根守恒,此时溶液中c(SO42-)= ×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)=
×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)=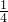 ×0.2mol/L×
×0.2mol/L× =0.025mol/L,由电荷守恒可知此时溶液中c(K+)=c(AlO2-)+2c(SO42-)=0.025mol/L+2×0.1mol/L=0.225mol/L,所以原混合溶液中为反应后溶液中c(K+)为0.225mol/L×2=0.45mol/L.
=0.025mol/L,由电荷守恒可知此时溶液中c(K+)=c(AlO2-)+2c(SO42-)=0.025mol/L+2×0.1mol/L=0.225mol/L,所以原混合溶液中为反应后溶液中c(K+)为0.225mol/L×2=0.45mol/L.
故选:C.
点评:本题考查有关混合物的计算,题目浓度不大,注意根据质量守恒和电荷守恒的角度解答.
本题所属考点:【认识化学学科】
本题难易程度:【困难】