时间:2016-12-18 04:02:58
选择题 向-定量的Fe、FeO、Fe2O3的混合物中加入150mL?4 mol?L-1的稀硝酸,恰好使混合物完全溶解,放出2.24L?NO(标准状况),往所得溶液中加入KSCN溶液,溶液不呈血红色.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A.O. 21?mol
B.0.25?mol
C.0.3?mol
D.0.35?mol
选择题 向-定量的Fe、FeO、Fe2O3的混合物中加入150mL?4 mol?L-1的稀硝酸,恰好使混合物完全溶解,放出2.24L?NO(标准状况),往所得溶液中加入KSCN溶液,溶液不呈血红色.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A.O.21?mol
B.0.25?mol
C.0.3?mol
D.0.35?mol
本题答案:B
本题解析:分析:混合物与硝酸反应时恰好使混合物完全溶解,且所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为硝酸亚铁,由铁元素守恒可知,足量的氢气在加热下还原相同质量的混合物,得到铁的物质的量与硝酸亚铁中的铁的物质的量相同,根据硝酸的物质的量和生成NO的物质的量,求出溶液中硝酸亚铁的物质的量.
解答:因一定量的Fe、FeO、Fe3O4和Fe2O3的混合物中加入150mL?4mol/L的稀硝酸,恰好使混合物完全溶解,所得溶液中加入KSCN溶液,无血红色出现,则溶液中的溶质为Fe(NO3)2,
2.24L?NO(标准状况)的物质的量为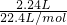 =0.1mol,
=0.1mol,
根据氮元素守恒,硝酸亚铁中的硝酸根离子的物质的量为0.15L×4mol/L-0.1mol=0.5mol,
所以硝酸亚铁的物质的量为0.5mol× =0.25mol,
=0.25mol,
由铁元素守恒可知,得到铁的物质的量为n(Fe)=0.25mol.
故选B.
点评:本题考查混合物的有关计算,关键是根据现象判断反应产物,利用原子守恒的方法来计算,难度中等.
本题所属考点:【有机化合物及其应用】
本题难易程度:【一般】