时间:2016-12-18 03:58:12
选择题 将51.2g?Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共0.8mol,这些气体恰好能被500mL 2mol/L?NaOH溶液完全吸收,溶液中生成NaNO3和NaNO2,则原混合气体中NO的物质的量为
A.0.3mol
B.0.4mol
C .0.5mol
D.0.6mol
选择题 将51.2g?Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共0.8mol,这些气体恰好能被500mL 2mol/L?NaOH溶液完全吸收,溶液中生成NaNO3和NaNO2,则原混合气体中NO的物质的量为
A.0.3mol
B.0.4mol
C.0.5mol
D.0.6mol
本题答案:A
本题解析:分析:根据化学式NaNO3和NaNO2中钠原子和氮原子的关系计算氮原子的物质的量,根据钠盐中氮原子和混合气体中氮原子的关系计算二氧化氮的物质的量,再根据氧化还原反应中得失电子守恒计算一氧化氮的物质的量.
解答:化学式NaNO3和NaNO2中氮原子和钠原子个数之比为1:1,根据钠原子守恒得氢氧化钠和氮原子的关系,n(?NaOH)=n(?Na+)=n(N)=2mol/L×0.5L=1mol,含NO、N2O4、NO2的混合气体共0.8mol,所以多出的氮原子就是N2O4中的氮原子,其物质的量是(1-0.8)mol=0.2mol,一个N2O4分 91ExaM.org子中比一个NO或NO2中多一个N原子,所以n(N2O4)=0.2mol,所以n(NO)+n(NO2)=0.6mol.
51.2g?Cu的n(Cu)=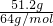 =0.8mol.
=0.8mol.
设NO的物质的量是xmol,根据氧化还原反应中得失电子数相等列等式.
铜失电子的物质的量等于硝酸中氮原子得电子的物质的量.
0.8mol×2=3×1×xmol+0.2mol×2+(0.6mol-xmol)×1
x=0.3
故选A.
点评:本题考查了有关混合物的计算,难度不大,明确氧化还原反应中得失电子数相等是解本题的关键.
本题所属考点:【有机化合物及其应用】
本题难易程度:【一般】