时间:2016-12-18 03:52:48
选择题 将11.2g的Mg-Cu混合物完全溶解于足量的硝酸中,收集反应产生的X气体(假定产生的气体全部逸出).再向所得溶液中加入足量的NaOH溶液,产生21.4g沉淀.气体X的成分可能是
A.0.3mo1NO2和0.3mo1NO
B.0.1mol N 91eXAm.orgO、0.2mol NO2和0.05mol N2O4
C.0.2mo1NO2和0.1mo1N2O4
D.0.6mo1NO
选择题 将11.2g的Mg-Cu混合物完全溶解于足量的硝酸中,收集反应产生的X气体(假定产生的气体全部逸出).再向所得溶液中加入足量的NaOH溶液,产生21.4g沉淀.气体X的成分可能是
A.0.3mo1NO2和0.3mo1NO
B.0.1mol NO、0.2mol NO2和0.05mol N2O4
C.0.2mo1NO2和0.1mo1N2O4
D.0.6mo1NO
本题答案:B
本题解析:分析:向Mg-Cu混合物与足量的硝酸反应所得溶液中加入足量的NaOH溶液,产生21.4g沉淀为氢氧化镁、氢氧化铜,所以沉淀中氢氧根的质量为21.4g-11.2g=10.2g,物质的量为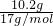 =0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,结合选项根据电子转移守恒判断.
=0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,结合选项根据电子转移守恒判断.
解答:向Mg-Cu混合物与足量的硝酸反应所得溶液中加入足量的NaOH溶液,产生21.4g沉淀为氢氧化镁、氢氧化铜,所以沉 淀中氢氧根的质量为21.4g-11.2g=10.2g,物质的量为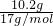 =0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,
=0.6mol,根据电荷守恒可知,11.2g的Mg-Cu提供的电子为0.6mol,
A、生成0.3mo1NO2和0.3mo1NO,N元素获得电子为0.3mol×(5-4)+0.3mol×(5-2)=1.2mol,得失电子不相等,故A错误;
B、生成0.1mol NO、0.2mol NO2和0.05mol N2O4,N元素获得电子为0.1mol×(5-2)+0.2mol×(5-4)+0.05mol×2×(5-4)=0.6mol,得失电子相等,故B正确;
C、生成0.2mo1NO2和0.1mo1N2O4,N元素获得电子为0.2mol×(5-4)+0.1mol×2×(5-4)=0.4mol,得失电子不相等,故C错误;
D、生成0.6molNO,N元素获得电子为0.6mol×(5-2)=1.8mol,故D错误.
故选:B.
点评:考查混合物的计算、氧化还原反应计算等,难度中等,计算金属提供的电子的物质的量是解题的关键,注意守恒思想的运用.
本题所属考点:【有机化合物及其应用】
本题难易程度:【简单】