时间:2016-12-17 09:19:49
选择题 把0.2mol/L NH4Cl溶液与0.1mol/L NaOH溶液等体积混合后溶液中下列微粒的物质的量浓度的关系正确的是
A.[NH4+]=[Na+]=[OH-]>[NH3·H2O]
B.[NH4+]= [Na+]>[NH3·H2O]>[OH-]
C.[NH4+]>[Na+]>[OH-]>[NH3·H2O]
D.[NH4+]>[Na+]>[NH3·H2O]>[OH-]
选择题 把0.2mol/L NH4Cl溶液与0.1mol/L NaOH溶液等体积混合后溶液中下列微粒的物质的量浓度的关系正确的是
A.[NH4+]=[Na+]=[OH-]>[NH3·H2O]
B.[NH4+]=[Na+]>[NH3·H2O]>[OH-]
C.[NH4+]>[Na+]>[OH-]>[NH3·H2O]
D.[NH4+]>[Na+]>[NH3·H2O]>[OH-]
本题答案:D
本题解析:此类型题目,若发生化学反应,优先考虑化学反应,通过化学反应各种离子浓度能比较出来,则不必考虑水解和电离,因为弱电解质电离或盐的水解程度都很小,对离子浓度,影响不大,若通过化学反应各种离子浓度大小比较不出来则再考虑水解和弱电解质电离。此题中NH4Cl和NaOH发生反应:NH4Cl+NaOH=NaCl+NH3·H2O生成NH3·H2O,同时NH4+有剩余若不考虑NH3·H2O电离和NH4+水解,有[NH3·H2O]=[NH4+]=[Na+]=0.5mol/L,此时考虑电离和水解: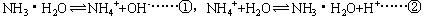
①发生使溶液 [NH4+]增大,②反应使溶液[NH4+]减小,溶液[NH4+]是增大还是减小,取决于两个反应哪一个为主要,根据经验规则可知,盐的水解和弱电解质的电离,以电离为主,因此[NH4+]增大,大于[Na+],同样分别[NH3·H2O]应减少,小于[Na+],溶液中[OH-]来自NH3·H2O电离,电离很微弱,[OH-]浓度很小,故微粒浓度顺序为[NH4+]>[Na+]>[NH3·H2O]>[OH-],选择D。
本题所属考点:【盐类水解的原理】
本题难易程度:【一般】