时间:2025-06-26 04:07:22
1、选择题 已知:常温下醋酸铵溶液的PH=7现有常温下的4组混合溶液,分别由等体积0.1mol/l的2种溶液混合而成①NH4Cl与NaOH?②NH4Cl与?HCl?③NH4Cl?与NaCl?④NH4Cl与?NaHCO3?下列各项正确的是( )
A.C(NH3?H2O)大小顺序:②>④>③>①
B.混合溶液④中存在C(NH3?H2O)+C(CO32-)+C(H+)=C(OH-)+C(H2CO3)
C.混合溶液④中存在C(NH4+)<C(HCO3-)+2C(CO32-)
D.PH大小顺序①>④>③>②
参考答案:A、①NH4Cl与NaOH反应生成等浓度的氯化钠和一水合氨,②NH4Cl中铵根离子水解生成一水合氨,盐酸抑制其水解,③NH4Cl中铵根离子水解生成一水合氨,氯化钠对铵根离子的水解无影响,④NH4Cl中铵根离子水解生成一水合氨,碳酸氢钠对铵根离子水解起到促进作用,所以一水合氨的浓度大小顺序是:①>④>②>③,故A错误;
B、NH4Cl与?NaHCO3?的混合溶液中,C(HCO3-)+2C(CO32-)+C(OH-)+C(Cl-)=C(H+)+C(Na+)+C(NH4+),C(NH4+)+C(NH3?H2O)=C(Cl-),C(HCO3-)+C(CO32-)+C(H2CO3)=C(Na+),且C(Cl-)=C(Na+),联立以上等式可得:C(NH3?H2O)+C(CO32-)+C(OH-)=C(H+)+C(H2CO3),故B错误;
C、NH4Cl与?NaHCO3?的混合溶液中,存在电荷守恒:C(HCO3-)+2C(CO32-)+C(OH-)+C(Cl-)=C(H+)+C(Na+)+C(NH4+),C(Cl-)=C(Na+),即C(HCO3-)+2C(CO32-)+C(OH-)=C(H+)+C(NH4+),醋酸铵溶液的PH=7,所以醋酸根离子和铵根离子水解程度相同,碳酸氢根水解程度大于铵根的水解程度,即C(OH-)>C(H+),所以C(NH4+)>C(HCO3-)+2C(CO32-),故C错误;
D、①NH4Cl与NaOH反应生成氯化钠和一水合氨,一水合氨电离导致溶液显示碱性,碱性最强,②NH4Cl与?HCl混合液显示酸性,③氯化钠对铵根离子的水解无影响,铵根水解显示酸性,④醋酸铵溶液的PH=7,所以醋酸根离子和铵根离子水解程度相同,碳酸氢根水解程度大于铵根的水解程度,溶液显示碱性,即C(OH-)>C(H+),所以PH大小顺序为:①>④>③>②,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 下列水解的离子方程式正确的是
A.HS-+H2O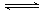 S2-+H3O+
S2-+H3O+
B.Fe3++3H2O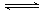 Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C.CO32-+2H2O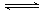 H2CO3+2OH-
H2CO3+2OH-
D.NH4++H2O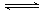 NH3·H2O+H+
NH3·H2O+H+
参考答案:D
本题解析:A:这是电离方程式,错误
B:水解是微弱过程,生成的碱不能标沉淀符号,不正确
C:多元弱酸根离子水解是分步进行的,并且以第一步水解为主,不正确
D:正确
本题难度:一般
3、选择题 下列各步制取物质,最终无法达到目的的有( )
A.Al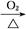 Al2O3
Al2O3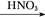 Al(NO3)3
Al(NO3)3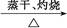 Al2O3
Al2O3
B.Cu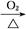 CuO
CuO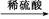 CuSO4溶液
CuSO4溶液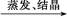 CuSO4·5H2O
CuSO4·5H2O
C.Fe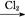 FeCl3
FeCl3 Fe(OH)3
Fe(OH)3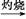 Fe2O3
Fe2O3
D.FeSO4溶液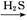 FeS
FeS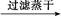 FeS
FeS
参考答案:D
本题解析:由于HNO3挥发,Al3+水解平衡右移,最后蒸干灼烧可得到Al2O3,所以A项正确;同理B、C两项正确。由于FeSO4与H2S不反应,故D项实验设计原理不正确,从而得不到FeS,所以D项错。
本题难度:一般
4、选择题 下列说法不正确的是
A.同温下,0.1 mol?L-1NH4Cl溶液中NH4+的浓度比0.1 mol?L-1氨水中NH4+的浓度大
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl多
C.电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
D.除去溶液中的Mg2+,用OH-比CO效果好,说明Mg(OH)2的溶解度比MgCO3的小
参考答案:B
本题解析:0.1 mol?L-1NH4Cl溶液完全电离,0.1 mol?L-1氨水部分电离,A错误。同离子效应用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少,电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气。Mg(OH)2的溶解度比MgCO3的小。
本题难度:一般
5、选择题 下列溶液中各微粒的浓度关系正确的是
A.0.1 mol·L-1 NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-]
B.0.1 mol·L-1Na2S溶液中:2[Na+]=[S2-]+[HS-]+[H2S]
C.0.1 mol·L-1 NaHCO3溶液中:[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-]
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:[Na+]=[CH3COO-]>[H+]=[OH-]
参考答案:C
本题解析:A、硫酸氢钠溶于水完全电离出H+、Na+、SO42-,所以0.1 mol·L-1 NaHSO4溶液中离子浓度大小关系是[H+]>[Na+]=[SO42-]>[OH-],A不正确;B、根据物料守恒可知 0.1 mol·L-1Na2S溶液中:[Na+]=2[S2-]+2[HS-]+2[H2S],B不正确;C、根据电荷守恒可知0.1 mol·L-1 NaHCO3溶液中:[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-],C正确;D、乙酸是弱酸,则 等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后恰好反应生成的乙酸钠水解,溶液显碱性,则溶液中离子浓度大小关系是[Na+]>[CH3COO-]>[OH-]>[H+],D不正确,答案选C。
本题难度:一般