时间:2025-06-26 04:02:27
1、选择题 足量的铁与一定量的稀硫酸充分反应,共收集到标准状况下气体为3.36 L,则参加反应的铁的质量为
A.5.6 g
B.8.4 g
C.11.2 g
D.无法计算
2、选择题 下列叙述正确的是( )
A.1.00molNaCl中含有6.02×1023个NaCl分子
B.1.00molNaCl中,所有Na+的最外层电子总数为8×6.02×1023
C.欲配置1.00L,1.00mol.L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中
D.电解58.5g熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠
3、选择题 在标准状况下,在三个干燥的烧瓶内分别装入:纯净的NH3,含有少量空气的NH3,NO2和O2的混合气体[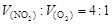 ]。然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为( )
]。然后分别做喷泉实验,三个烧瓶中所得溶液的物质的量浓度之比为( )
A.21︰12︰4
B.5︰5︰4
C.5︰5︰1
D.无法确定
4、选择题 体积比为1 : 2 : 3所组成的N2、O2和CO2混合气体100 g在标准状况下体积为( )
A.60 L
B.30 L
C.11.2 L
D.112 L
5、选择题 (一)5mol的CO2与8mol的SO2的分子数比是 ;原子数比是 ;质量比是 。
(二)KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:
KClO3+ HCl(浓) → KCl+ ClO2+ Cl2+ H2O
(1)配平以上化学方程式(化学计量数填入划线上)。
(2) ClO2是反应的 (填氧化或还原)产物。
(3)浓盐酸在反应中显示出来的性质是(填写号码)
①还原性 ②氧化性 ③酸性 ④碱性
(4)反应产生0.1 mol Cl2,则转移的电子的物质的量为 mol
(5)ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位质量得到电子数表示)是Cl2的 倍(保留2位小数)。