时间:2025-06-26 03:55:46
1、选择题 某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度,有关叙述正确的是(? )
A.H2Y在电离时:H2Y+H2O HY-+H3O+
HY-+H3O+
B.在该盐的溶液中,离子浓度为:c(Na+)>c(HY-)>c(Y2-)>c(OH-)>c(H+)
C.在该盐的溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
D.HY-水解方程式为:HY-+H2O Y2-+H3O+
Y2-+H3O+
2、填空题 (1)已知在常温下测得浓度均为0.1 mol/L的下列5种溶液的pH: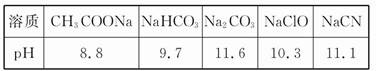
根据上述信息判断,浓度均为0.05 mol/L的下列5种物质的溶液中,pH最小的是?(填编号);其pH为?(填数值);pH最大的是?(填编号)。
①CH3COOH?②HCN?③HClO ?④H2SO4?⑤HClO4
(2)下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液。
②在侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体。
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体。
根据上述反应,总结出复分解反应发生的一个规律:?;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是?,
请写出反应的离子方程式:?。
3、选择题 根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
| 化学式 | 电离常数 |
| HClO | K=3×10-8 |
| H2CO3 | K1=4.3×10-7 |
| K2=5.6×10-11 |
4、选择题 已知HCN的电离常数K=6.2×10-10。用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,经测定溶液呈碱性。则下列关系式正确的是
A.c(CN-)>c(Na+)
B.c(CN-)<c(HCN)
C.c(HCN)+ c(CN-)=0.2mol·L-1
D.c(CN-)+ c(OH-)=0.1mol·L-1
5、选择题 实验中在对某种样品进行检验时,加入试剂顺序的不同对最后结果的判断具有很大影响。某样品中可能含有SO42-,实验中加入试剂种类和顺序正确的是(? B )
A.BaCl2溶液,稀盐酸?B.稀盐酸,BaCl2溶液
C.BaCl2溶液,稀硝酸?D.稀硝酸,BaCl2溶液