时间:2025-06-26 03:53:06
1、选择题 在密闭容器中进行如下反应:H2(g)+I2(g)?2HI(g);△H,在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是( )
A.T1>T2,△H>0
B.T1>T2,△H<0
C.T1<T2,△H>0
D.T1<T2,△H<0
参考答案:D
本题解析:
本题难度:简单
2、选择题 反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
①m+n>p;②x点表示该反应的正反应速率大于逆反应速率;
③n>p;?④x点时比y点时的反应速率慢.
A.只有①
B.只有②④
C.只有①②④
D.只有①和③
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列有关平衡常数说法正确的是( )
A.温度越高,K值越大
B.K值越大,反应的转化率越小
C.K值越大,反应的转化率越大
D.K值的大小与起始浓度有关
参考答案:C
本题解析:
本题难度:一般
4、填空题 某温度时,在2L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示.
(1)由图中所给数据进行分析,该反应的化学方程式为______;
(2)反应从开始至2min末,用Z的浓度变化表示的反应速率为v(Z)=______.
(3)若X、Y、Z均为气体,2min后反应达到平衡,平衡时体系的压强是开始时的______倍.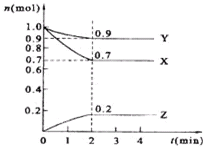
参考答案:(1)、由图象可以看出,X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,则X、Y为反应物,Z为生成物,2min后,X、Y的物质的量为定值且不为零,为可逆反应,相同时间内物质的量的变化比值为:△n(X):△n(Y):△n(Z)=(1.0-0.7)mol:(1.0-0.9)mol:0.2mol=3:1:2,则化学方程式为3X+Y 2Z,
2Z,
故答案为:3X+Y 2Z;
2Z;
(2)、反应开始至2min,气体Z的平均反应速率为v=0.2mol2L2min=0.05mol/(L.min),
故答案为:0.05mol/(L.min);
(3)、反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,
起始时气体的总物质的量为:1.0mol+1.0mol=2.0mol,
反应达平衡时,此时容器内的压强与起始压强之比为1.8mol:2.0mol=9:10,此时体系的压强是开始时的 0.9倍
故答案为:0.9.
本题解析:
本题难度:一般
5、选择题 在一体积固定的密闭容器中,进行化学反应: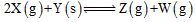 ,若其化学平衡常数(K)和温度(℃)的关系如下表
,若其化学平衡常数(K)和温度(℃)的关系如下表
对该反应而言,下列说法正确的是
[? ]
A.该反应正反应为放热反应
B.K越大,反应物的转化率越大
C.温度不变,增加X的用量,K增大
D.达平衡后,加入催化剂,平衡向正反应方向移动
参考答案:B
本题解析:
本题难度:一般