时间:2025-06-26 03:51:31
1、选择题 下列叙述不正确的是
A.工业上电解饱和食盐水的阳极反应:2Cl--2e-=Cl2↑
B.铁船船体上镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+ 2H2O+4e-= 4OH-
D.原电池负极发生的电极反应是还原反应
参考答案:D
本题解析:原电池中,负极失去电子,发生氧化反应,所以选项D是错误的,其余都是正确的,答案选D。
本题难度:简单
2、填空题 工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g)? ΔH
CH3OH(g)? ΔH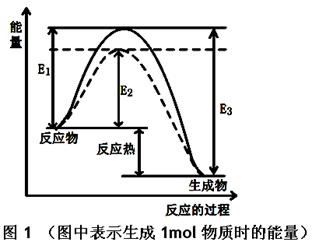
(1)根据图1请写出合成甲醇的热化学方程式?
(热量用E1、E2或E3表示)。
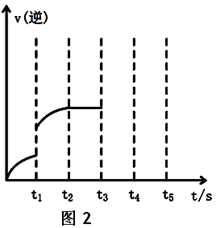
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是?。
(3)判断反应达到平衡状态的依据是?(填字母序号,下同)。
A.2v(H2)(逆) =v(CO)(正)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1?
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为?。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是?(“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度?(填“增大”、“不变”或“减小”)。
(5)某甲烷燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见右图)。A物质的化学式是_________;该原电池的负极反应式可表示为?。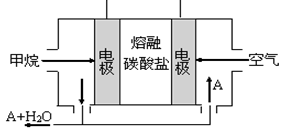
参考答案:
(1)CO(g) + 2H2(g)  CH3OH(g)?ΔH=(E1-E3)或-(E3-E1)kJ?mol-1
CH3OH(g)?ΔH=(E1-E3)或-(E3-E1)kJ?mol-1
(2分,没写物质状态不给分,不写单位不扣分)
(2)加压、等倍增加反应物和生成物、增加甲醇浓度、升高温度、使用催化剂等(2分)(任答一个合理答案给分。注:t1时刻不能确认是否平衡)
(3)CD(2分,见错不给分)
(4)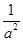 (2分)正向移动(2分)增大(1分)
(2分)正向移动(2分)增大(1分)
(5)A为CO2(2分)CH4+4CO32--8e- =5CO2+2H2O (2分)
本题解析:(1)由图中可知,E1为断裂化学键所需要的能量,E3为形成化学键时所释放的能量,故每生成1mol甲醇的反应热为(E1—E3)KJ/mol。
(2)从图2曲线上可以看出,t1时刻前和t1时刻后,逆反应速率瞬间增大,可使反应速率增大的因素有增压、升温、加催化剂和增大物质浓度。
(3)判断反应是否达到平衡的依据是正逆反应速率相等和各物质浓度保持不变。在该反应中,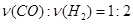 ,即
,即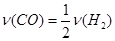 ,故A项不能说明反应已达到平衡状态;该反应在恒容容器中进行,反应物生成物都是气态,因此气体总质量和总体积一直不变,密度也一直不变,因此B项也不能说明反应达到平衡状态;当物质的质量以克为单位时,平均相对分子质量在数值上等于平均摩尔质量,
,故A项不能说明反应已达到平衡状态;该反应在恒容容器中进行,反应物生成物都是气态,因此气体总质量和总体积一直不变,密度也一直不变,因此B项也不能说明反应达到平衡状态;当物质的质量以克为单位时,平均相对分子质量在数值上等于平均摩尔质量,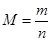 ,因为该反应是一个气体分子数目发生变化的反应,气体的物质的量也会发生变化,只有当反应达到平衡后,气体的物质的量才不再变化,即平均相对分子质量不再变化,因此C项可说明反应达到平衡状态;D项各物质浓度不再变化,反应达到平衡状态;反应达到平衡时,各物质的百分含量一定,物质间的比例一定,但数值不一定是1:2:1,E项不能说明反应达到平衡状态。
,因为该反应是一个气体分子数目发生变化的反应,气体的物质的量也会发生变化,只有当反应达到平衡后,气体的物质的量才不再变化,即平均相对分子质量不再变化,因此C项可说明反应达到平衡状态;D项各物质浓度不再变化,反应达到平衡状态;反应达到平衡时,各物质的百分含量一定,物质间的比例一定,但数值不一定是1:2:1,E项不能说明反应达到平衡状态。
(4)反应消耗CO的物质的量:2a×50%=amol。
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
初始量:2amol? 4amol? 0
变化量:amol? 2amol? amol
平衡量:amol? 2amol? amol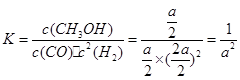
若再向该容器中投入a mol CO、2amol H2和amol CH3OH,相当于增大气体压强,平衡正向移动。与原平衡相比,因为增加了CO的量,但容器容积未变,所以CO的浓度增大。
(5)该电池为甲烷燃料电池,电池总反应为CH4+2O2=CO2+2H2O,电池的电解质为碳酸盐,且电解质溶液组成保持稳定,所以循环的物质应为CO2。燃料电池负极应通入燃料,故负极反应式为:CH4+4CO32--8e- =5CO2+2H2O。
本题难度:困难
3、选择题 为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq) ===2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O Al2O3+3H2,电解过程中,以下判断正确的是
Al2O3+3H2,电解过程中,以下判断正确的是
| | 电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3 molPb | 生成2 molAl2O3 |
| C | 正极:PbO2+4H++2e-===Pb2++2H2O | 阳极:2Al+3H2O-6e-===Al2O3+6H+ |
| D |  |  |
参考答案:D
本题解析:A、原电池中,溶液中氢离子向正极移动,故不选A;B、串联电池中转移电子数相等,每消耗3摩尔铅,根据电子守恒,生成1摩尔的氧化铝,故不选B;C、原电池正极上二氧化铅得到电子生成硫酸铅,故不选C;D、原电池中铅做负极,负极上铅变成硫酸铅,质量增加,在电解池中,铅为阴极,阴极上氢离子得电子,生成氢气,所以电极质量不变,故选D。
考点:原电池和电解质的原理。
本题难度:一般
4、填空题 (14分)天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”)。
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)  2CO(g)+2H2(g) 。
2CO(g)+2H2(g) 。
①该反应的平衡常数表达式为 。
②在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。
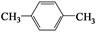
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图2,则X的结构简式为 。
参考答案:(1)CO2+8e-+8H+=CH4+2H2O (2分) 硫酸 (2分)
(2)2NH4HS+O2=2NH3·H2O+2S↓ (2分)
(3)①K=c2(CO)·c2(H2)/ c(CO2)·c (CH4) (2分) ②小于(2分) 大于 (2分)
(4) (2分)
(2分)
本题解析:(1) ①分析题给装置知,铜电极表面CO2转化为 CH4,电解质溶液呈酸性,利用氢离子和水平衡电荷和原子,电极反应式CO2+8e-+8H+=CH4+2H2O;②盐酸易挥发,为防止副反应的发生,可向装置中加入少量硫酸;(2)一定条件下向NH4HS溶液中通入空气,得到单质硫和一水合氨,该反应的化学方程式2NH4HS+O2=2NH3·H2O+2S↓;(3)①根据CO2(g)+CH4(g)  2CO(g)+2H2(g) 写出该反应的平衡常数表达式为K=c2(CO)·c2(H2)/ c(CO2)·c (CH4);②根据图像知,当温度相同时,压强为P1时甲烷的平衡转化率比压强为P2的高,说明平衡正向移动,该反应的正反应为气体物质的量增大的反应,改变的条件为减小压强,则压强P1小于P2(填“大于”或“小于”);压强为P2时,Y点CH4的转化率比平衡时低,,要想达到平衡状态,反应正向进行,v(正) 大于v(逆);(4)根据题给信息知,芳香烃X的相对分子质量为106,分子中含有2中氢原子,为对二甲苯,结构简式为
2CO(g)+2H2(g) 写出该反应的平衡常数表达式为K=c2(CO)·c2(H2)/ c(CO2)·c (CH4);②根据图像知,当温度相同时,压强为P1时甲烷的平衡转化率比压强为P2的高,说明平衡正向移动,该反应的正反应为气体物质的量增大的反应,改变的条件为减小压强,则压强P1小于P2(填“大于”或“小于”);压强为P2时,Y点CH4的转化率比平衡时低,,要想达到平衡状态,反应正向进行,v(正) 大于v(逆);(4)根据题给信息知,芳香烃X的相对分子质量为106,分子中含有2中氢原子,为对二甲苯,结构简式为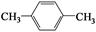 。
。
考点:考查电极方程式的书写,化学平衡及有机物结构式的确定。
本题难度:困难
5、填空题 (10分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中C02的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)下列关于C02的用途不正确的是?(填序号)。
A.二氧化碳能溶于水,可用于生产碳酸型饮料
B.固体二氧化碳俗称干冰,可用于人工降雨
C.二氧化碳用于灭火是因为降低了可燃物的着火点
D.超临界二氧化碳作萃取溶剂用于从天然产物提取和净化活性组分
E.二氧化碳可以作为气肥,提高农作物的产量
(2)目前工业上有一种方法是用C02来生产甲醇。为探究其反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)? ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)? ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率:v(H。)=??。
②该反应的平衡常数为?。
(3)以KHC03溶液为电解质,用电解的方法也可以将CO2还原为甲醇。请写出电解时阴极的离子方程式:?
(4)金刚石、石墨烯、线型碳是碳的几种同素异形体。从键的类型分析它们的稳定性由强到弱的顺序为?
参考答案:(10分)
(1)C?(2分)
(2)①0.225mol?L-1?min-1(2分)。② 5.33( mol?L-1)-2 (单位不作要求,2分)
(3)CO2+6HCO3-+6e-=CH3OH+6CO32-+H2O(或CO2+5H2O+6e-=CH3OH+6OH -)(2分)
(4)线型碳>石墨烯>金刚石(2分)
本题解析:(1)燃烧的必要条件是可燃物达到着火点且有氧气,二氧化碳用于灭火主要是采用将可燃物与氧气隔离的办法达到目的
(2)①v(CO2)=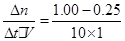 =0.075mol?L-1?min-1,由方程式的系数比可知v(H2)=3v(CO2)=0.225mol?L-1?min-1
=0.075mol?L-1?min-1,由方程式的系数比可知v(H2)=3v(CO2)=0.225mol?L-1?min-1
②依据所给数据,平衡常数K=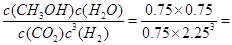 5.33( mol?L-1)-2
5.33( mol?L-1)-2
(3)由化合价的升降可知,CO2中的碳元素与+4价降到CH3OH中碳元素的—2价,得电子,发生了还原反应,故:CO2+6e- CH3OH,溶液为碱性环境,为达到电荷守恒,则CO2+6e-
CH3OH,溶液为碱性环境,为达到电荷守恒,则CO2+6e- CH3OH+6OH -,再根据原子守恒得:CO2+5H2O+6e-=CH3OH+6OH -)
CH3OH+6OH -,再根据原子守恒得:CO2+5H2O+6e-=CH3OH+6OH -)
(4)物质内的键的键能越大,则物质越稳定,由于键能顺序为:碳碳叁键>碳碳双键>碳碳单键,故稳定性由强到弱的顺序为:线型碳>石墨烯>金刚石
本题难度:简单