时间:2025-06-26 03:48:16
1、选择题 下列说法不正确的是
?[? ]
A.镀层破损后,镀镀锌铁板比锡铁板更耐腐蚀
B.据能量守恒定律,反应物的总能量一定等于生成物的总能量
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D、等质量的硫固体和硫蒸气分别完全燃烧,后者放出的热量多
参考答案:B
本题解析:
本题难度:一般
2、填空题 (12分).铅蓄电池是典型的可充型电池,电池总反应式为: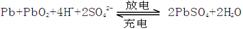
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是______________________ ;电解液中H2SO4的浓度将变 ______ ;当外电路通过1 mol电子时,理论上负极板的质量增加 _______? g。
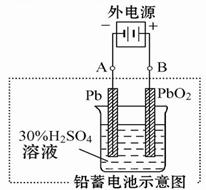
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成 _____?___ ,电极反应:__________________ ,B电极反应_______________。
参考答案:(12分,每空2分)
(1)PbO2+2e-+4H++ SO42- = PbSO4 + 2H2O?、小?、 48
(2)Pb? A极反应: PbSO4+2e- =" Pb" + SO42-?
B极反应: PbSO4+2H2O-2e- = PbO2+4H++ SO42-
本题解析:(1)原电池中正极得到电子,发生还原反应。所以根据放电时的方程式可知,正极的电极反应式是PbO2+2e-+4H++ SO42- = PbSO4 + 2H2O。放电是消耗硫酸的,所以硫酸的浓度变小。负极失去电子,发生氧化反应,所以负极电极反应式是Pb-2e-+ SO42- = PbSO4,所以当外电路通过1 mol电子时,理论上负极板的质量增加96g/mol×0.5mol=48g。
(2)根据装置图可知,A电极和电源的负极相连,作阴极,得到电子,所以是二氧化铅得到电子生成单质铅,电极反应式是bSO4+2e- =" Pb" + SO42-。B电极和电源的正极相连,作阳极,硫酸铅失去电子,得到二氧化铅,电极反应式是PbSO4+2H2O-2e- = PbO2+4H++ SO42-。
点评:书写电极反应式的关键是准确判断出原电池的正负极、电解池的阴阳极等。而在电化学的有关计算时,往往常用电子得失守恒。
本题难度:一般
3、填空题 甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+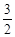 O2(g) ="=" CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g) ="=" CO2(g)+2H2O(l)。其工作原理示意图如下: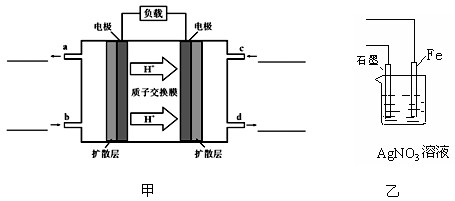
请回答下列问题:
(1)写出甲图中b、c两个入口通入的物质名称(或化学式)b??c?
(2)负极的电极反应式为?
(3)用该原电池电解AgNO3溶液,若Fe电极增重5.4g,则燃料电池在理论上消耗的氧气的体积为?mL(标准状况)
参考答案:①b 甲醇水溶液?c 氧气(2分)
②  (2分)③ 280 mL(2分)
(2分)③ 280 mL(2分)
本题解析:(1)由于原电池中氢离子向右侧移动,所以右侧是正极,左侧是负极。因此则b通入甲醇,因此c通入氧气。
(2)负极失去电子,所以方程式为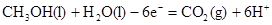 。
。
(3)Fe电极增重5.4g,说明析出银是5.4g,则转移电子是5.4g÷108g/mol=0.05mol,所以根据电子得失守恒可知,消耗氧气是0.05mol÷4=0.0125mol,体积是0.0125mol×22.4L/mol=0.28L=280ml。
本题难度:一般
4、选择题 下列有关金属腐蚀与防护的说法正确的是
[? ]
①纯银器表面在空气中因化学腐蚀而渐渐变暗;
②当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用;
③在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法;
④可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀。
A.①②
B.②③
C.③④
D.①③
参考答案:D
本题解析:
本题难度:简单
5、选择题 常温时,将500 ml pH=a的CuSO4和K2SO4的混合溶液用石墨电极电解一段时间,测得溶液的pH变为b(假设溶液体积的变化忽略不计),在整个电解过程中始终发现只有一个电极有气体产生。下列说法错误的是(?)
A.若使溶液恢复到电解前的浓度可以向溶液中加20(10-b-10-a)g CuCO3
B.b<a<7
C.阳极电极反应:2H2O—4e—=O2↑+4H+
D.整个过程中是阳极产生氧气,阴极析出铜单质
参考答案:A
本题解析:
本题的关键是看到在整个电解过程中始终发现只有一个电极有气体产生,马上就知道整个过程中是阳极产生氧气,阴极析出铜单质,要恢复电解前的溶液就要将氧气和铜的质量转化成CuO或CuCO3,需要20(10-b-10-a)g CuO。考虑水解a<7,电解转变成酸则b<a。
本题难度:一般