时间:2025-06-26 03:48:16
1、填空题 下图两个装置中用滴有酚酞的NaCl溶液做电解质溶液,进行化学能和电能相互转化的研究。请回答: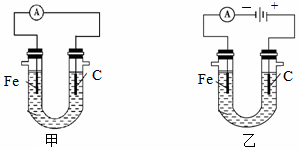
(1)写出两个铁电极上的电极反应式。
甲:?
乙:?
(2)甲装置中??电极附近的溶液先变红,乙装置中?电极附近的溶液先变红。
(3)检验乙中C电极反应产物的方法是?。
(4)电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:?。所得消毒液中离子浓度的由大到小顺序??。
(5)如果起始时乙中盛有足量一定浓度的CuSO4溶液,反应一段时间后,要使溶液恢复到以前的状态,可向溶液中加入一定量的?(填化学式)。
参考答案:(14分)(1)Fe —2e- = Fe2+?2H+ + 2e-= H2↑ ?(2)C? Fe?(每空1分)
(3)用湿润的淀粉碘化钾试纸靠近C电极所在一侧的支管口,试纸变蓝
(4)NaCl + H2O  ?NaClO + H2↑ ? c(Na+)> c(ClO-)>c(OH-) >c( H+)?(5)CuO(或CuCO3)
?NaClO + H2↑ ? c(Na+)> c(ClO-)>c(OH-) >c( H+)?(5)CuO(或CuCO3)
本题解析:(1)根据装置的特点可知,甲是原电池,铁是负极,发生吸氧腐蚀,负极电极反应式是Fe-2e-=Fe2+。乙是电解池,铁电极和电源的负极相连,作阴极,电极反应式是2H+ + 2e-= H2↑。
(2)甲装置中碳棒是正极,氧气得到电子,生成OH-,所以碳棒电极附近的溶液先变红;乙装置中铁电极是阴极,溶液中的氢离子放电,破坏了阴极周围水的电离平衡,所以阴极周围溶液显碱性,所以铁电极附近的溶液先变红。
(3)乙中C电极反应产物是氯气,具有强氧化性,所以检验的方法是用湿润的淀粉碘化钾试纸靠近C电极所在一侧的支管口,试纸变蓝。
(4)根据题意可知,氯气和氢氧化钠溶液反应生成物中只有一种溶质,所以该溶质是偏铝酸钠,则反应的化学方程式是NaCl + H2O  ?NaClO + H2↑。疲劳寿命水解显碱性,则溶液中离子浓度大小关系是c(Na+)> c(ClO-)>c(OH-) >c( H+)。
?NaClO + H2↑。疲劳寿命水解显碱性,则溶液中离子浓度大小关系是c(Na+)> c(ClO-)>c(OH-) >c( H+)。
(5)如果起始时乙中盛有足量一定浓度的CuSO4溶液,则电解的生成物是氧气、铜和稀硫酸。所以反应一段时间后,要使溶液恢复到以前的状态,可向溶液中加入一定量的CuO(或CuCO3)。
点评:该题是中等难度的试题,试题综合性强,贴近高考。侧重对学生能力的培养和解题方法的指导与训练。有助于培养学生的逻辑思维能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确原电池和电解池的工作原理,特别是电解池中离子的放电顺序,然后结合题意灵活运用即可。
本题难度:一般
2、选择题 某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如下实验.在一周的观察过程中,铁钉锈蚀的速度最慢的是( )
| 实验序号 | ① | ② | ③ 实验内容 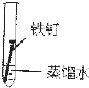 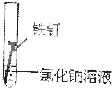 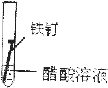 |
参考答案:①蒸馏水中不含氧气,所以铁钉和蒸馏水不能构成原电池;
②铁钉和氯化钠溶液能构成原电池,铁作负极而被腐蚀;
③铁钉和醋酸能发生氧化还原反应而被腐蚀,
所以铁钉腐蚀最慢的是①,故选A.
本题解析:
本题难度:简单
3、选择题 全世界短年钢铁因锈蚀造成大量的损失。某城市拟用如图方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是
A.土壤中的钢铁易被腐蚀是因为在潮湿的土壤中形成了原电池
B.金属棒X的材料应该是比镁活泼的金属
C.金属棒X上发生反应:M一ne一——Mn+
D.这种方法称为牺牲阳极的阴极保护法
参考答案:B
本题解析:由题意知,加入金属棒X后形成原电池,并使其作为阳极铁作阴极发生反应,避免铁失去电子被腐蚀,A、潮湿的土壤中有水和氧气,形成原电池环境,易被腐蚀,故A正确;B、金属棒X的材料比铁活泼,替代钢铁进行反应,但无法判断是否比镁活泼,故B错误;C、金属棒X作为负极发生反应失去电子,M一ne一——Mn+,故C正确;D、将还原性较强的金属X作为保护极,与被保护金属铁相连构成原电池,还原性较强的金属X作为负极发生氧化反应而消耗,被保护的金属铁作为正极就可以避免腐蚀,这种方法牺牲了阳极(原电池的负极)保护了阴极(原电池的正极),是牺牲阳极的阴极保护法,故D正确。
本题难度:一般
4、选择题 在面盆、痰盂等铁制品表面烧制搪瓷的目的是( )
A.防止铁生锈且美观
B.增大厚度防止磨损
C.增大硬度防止撞坏
D.美观和杀菌消毒作用
参考答案:A
本题解析:
本题难度:简单
5、选择题 每年由于腐蚀造成的钢铁损失约占年产量的10~20%,金属的防腐十分重要。钢铁防腐方法有许多种,图—1与图—2是两个典型的例子。对其中原理的描述正确的是?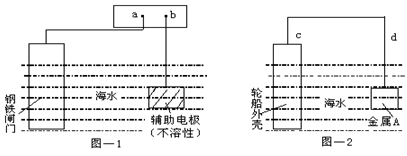
A.图—1:a为电源正极
B.图—1:辅助电极上的反应:O2+4e+2H2O→4OH-
C.图—2:电子流动方向d→c
D.图—2:金属A可以是耐腐蚀的金属铜
参考答案:C
本题解析:
正确答案:C
A、不正确,a应为电源负极;B、不正确,2H2O―4e― =O2+4H+?;C、正确;D、不正确,应是比铁活泼的金属。
本题难度:简单