时间:2025-06-26 03:46:01
1、选择题 美国Lawrece Liermore国家实验室(LINL)成功地在高压下将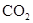 转化为具有类似
转化为具有类似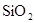 结构的原子晶体,下列关于
结构的原子晶体,下列关于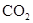 的原子晶体说法,正确的是:
的原子晶体说法,正确的是:
A.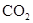 的原子晶体和分子晶体互为同分异构体
的原子晶体和分子晶体互为同分异构体
B.在一定条件下,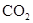 原子晶体转化为
原子晶体转化为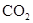 分子晶体是物理变化
分子晶体是物理变化
C.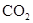 的原子晶体和
的原子晶体和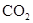 分子晶体具有相同的物理性质和化学性质
分子晶体具有相同的物理性质和化学性质
D.在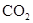 的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
的原子晶体中,每一个C原子周围结合4个O原子,每一个O原子跟两个C原子相结合
参考答案:D
本题解析:
A.原子晶体是由原子构成,C、O原子以共价键连成空间网状结构,不存在分子(而同分异构体前提是有分子构成的),所以不可能是同分异构体;
B.在一定条件下,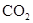 原子晶体转化为
原子晶体转化为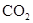 分子晶体,有化学键的改变,是化学变化;
分子晶体,有化学键的改变,是化学变化;
C.一个为分子晶体,一个为原子晶体,物理性质肯定不同;化学性质有和原子结构有密切关系,化学性质基本相同。
本题难度:简单
2、填空题 不锈钢是由铁、铬、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3防止腐蚀。
(1)写出Fe2+的基态离子的电子排布式:____;基态碳(C)原子的轨道表示式为 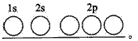
(2)[Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为_______;已知CrO5中Cr为+6价,则CrO5的结构式为________。
(3)H2O的分子构型为____;H2O分子间能形成氢键的原因是__________。
(4)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是________。 
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。 体心立方晶胞与面心立方晶胞中实际含有的Fe原子个数之比为____。 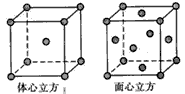
参考答案:(1) 1s22s22p63s23p63d6 ;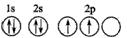
(2)6 ;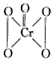
(3)V形分子;分子中有带孤电子对、电负性较强的氧原子
(4)A
(5)2:4(或1:2)
本题解析:
本题难度:一般
3、选择题 有四种物质:①四氯化碳?②白磷?③甲烷?④石墨,其中分子具有正四面体结构的是( )
A.①②③
B.①③④
C.①②
D.②③
参考答案:A
本题解析:
本题难度:简单
4、填空题 某金属(A)在TK以下晶体的基本结构单元如左下图所示,T K以上转变为右下图所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同

(1)在T K以下的纯A晶体中,与A原子等距离且最近的A原子数为______个;在T K以上的纯A晶体中,与A原子等距离且最近的A原子数为___________;
(2)纯A晶体在晶型转变前后,二者基本结构单元的边长之比为(TK以上与TK以下之比)___________。
(3)右上图的的堆积方式为 ,经测定其结构和性质参数如下表所示
| 金属 | 相对原子质量 | 分区 | 密度/g·㎝-3 | 原子化热/kJ·mol-1 |
| Na | 22.99 | s区 | 0.960 | 108.4 |
| A | 60.20 | d区 | 7.407 | 7735 |
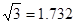 ,7.407≈
,7.407≈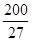 ,1pm=10
,1pm=10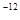 m)
m)参考答案:(1)8、12(各1分)(2)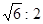 (2分)(3)体心立方(2分) 129.9(2分)
(2分)(3)体心立方(2分) 129.9(2分)
由于A处于d区价电子多,且半径小所以原子化热很高(2分)
本题解析:(1)根据晶胞结构可知,在T K以下的纯A晶体中,与A原子等距离且最近的A原子数为8个;而在T K以上的纯A晶体中,与A原子等距离且最近的A原子数为12个。
(2)设原子半径是r,则在T K以上的晶体中边长是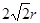 ,而在在T K以下的纯A晶体中边长是
,而在在T K以下的纯A晶体中边长是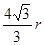 ?,所以二者之比是
?,所以二者之比是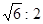 。
。
(3)由晶胞结构可知,T K以上的堆积方式为体心立方堆积;则有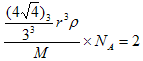
带入数据解得r=129.9pm;由于由于A处于d区价电子多,且半径小所以原子化热很高。
本题难度:一般
5、填空题 (15分)[物质结构与性质] 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍。X原子的M能层上有4个未成对电子。请回答下列问题:
(1)写出C、D、E三种原子第一电离能由大到小的顺序为_______________。
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为_____________,根据价层电子对互斥理论预测BA2D的分子构型为____________。
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个BC-。与A同族且相差两个周期的元素R的离子位于立方体的恰当位置上。根据其结构特点可知该晶体的化学式为(用最简正整数表示)________
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体
结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
参考答案:(1)F>N>O(2分)(2)H2O>NH3>CH4(2分)、(平面)三角形(2分)
(3)NaFe2(CN)6(3分)(4)TiN>MgO>KCl (2分)? 6 (2分)(5)Cr2O3(2分)
本题解析:略
本题难度:一般