时间:2025-06-26 03:45:13
1、选择题 下表中所示物质或概念间的从属关系符合如图的是( )
| X | Y | Z A 钠元素 主族元素 短周期元素 B 氢氧化铁 胶体 分散系 C 电解质 化合物 纯净物 D 置换反应 氧化还原反应 放热反应 |
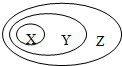
参考答案:A、钠元素为主族元素,主族元素中一、二、三周期属于短周期元素,主族元素中四、五、六、七周期属于长周期元素,故A错误;
B、胶体属于分散系,而分散系都是由两种以上的物质组成,则属于混合物,故B错误;
C、电解质属于化合物,化合物都是纯净物,故C正确;
D、置换反应属于氧化还原反应,而氧化还原反应不一定是放热反应,故D错误;
故选:C.
本题解析:
本题难度:简单
2、选择题 对反应:3Cl2+6KOH═5KCl+KClO3+3H2O,以下说法中正确的是( )
A.Cl2是氧化剂,KOH是还原剂
B.氧化剂质量是还原剂质量的5倍
C.氧化产物与还原产物的物质的量之比为5:1
D.反应过程中3molCl2共转移6mol电子
参考答案:B
本题解析:
本题难度:简单
3、填空题 在下述反应中,属于取代反应的是______;属于氧化反应的是______;属于加成反应的是______.
①乙烯使溴水褪色?②乙烯使酸性高锰酸钾溶液褪色?③苯与浓硝酸制硝基.
参考答案:①乙烯使溴水褪色是因为乙烯和溴水中的溴单质发生了加成反应的结果;
②乙烯使酸性高锰酸钾溶液褪色,是高锰酸钾和乙烯发生了氧化反应的结果;
③苯与浓硝酸在浓硫酸的作用下,苯环上的氢原子被硝基取代的而生成了硝基苯,属于取代反应.
故答案为:③②①.
本题解析:
本题难度:简单
4、简答题 对钢铁零件进行表面发蓝处理可大大增强抗蚀能力.其主要工艺如下:
(1)预处理:把钢铁零件分别浸入105℃的1.0mol/L?Na2CO3溶液→20℃水→20℃30%盐酸→20℃水.其中酸浸的目的是______.
(2)氧化发蓝处理:把预处理后钢铁零件浸入140℃1L发蓝液中(15.6mol/L NaOH、3.26mol/L NaNO2),发生如下反应:
3Fe+NaNO2+5NaOH=3Na2FeO2+NH3+H2O;
3Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3+7NaOH
Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
总反应可以表示为______.测得发蓝处理残留液NaOH浓度为16.0mol.L-1,则反应中转移电子为______mol(假设体积不变)
(3)氧化膜致密性检查:①浓硝酸、硫酸、③氯水、④硫酸铜溶液、⑤KSCN溶液、⑥NaOH溶液.请选用上述合适试剂设计方案,检查发蓝零件的氧化膜致密性是否合格.填写下表:
| 实验步骤 | 现象 | 结论 ______ ______ 产品不合格 |
参考答案:(1)钢铁零件浸入盐酸中,i表面的铁锈可以和酸反应生成易溶的盐和水,目的是除锈,故答案为:除去零件表面的铁锈;
(2)金属铁可以被亚硝酸钠氧化为四氧化三铁,将三个化学方程式处理后合并,则9Fe+4NaNO2+8H2O=3Fe3O4+4NH3+4NaOH,发蓝处理残留液NaOH浓度为16.0mol.L-1,即生成氢氧化钠的物质的量是0.4mol,转移电子的物质的量为:0.4mol(9×83)×14=2.4mol,故答案为:9Fe+4NaNO2+8H2O=3Fe3O4+4NH3+4NaOH;2.4;
(3)如果烤蓝不合格,金属铁可以和硫酸铜发生反应置换出金属铜,会出现红色斑点,故答案为:将零件浸没在硫酸铜溶液中;零件表面出现红色斑点;
(4)次氯酸根离子具有氧化性,可以将亚硝酸根离子氧化为硝酸根离子,实质是:NO2-+ClO-=NO3-+Cl-,故答案为:NO2-+ClO-=NO3-+Cl-.
本题解析:
本题难度:一般
5、简答题 偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是______.
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)?2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为______(填“吸热”或“放热”)反应.
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol?N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是______.若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数______(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=______?mol/(L?s)-1.
(4)NO2可用氨水吸收生成NH4NO3.25℃时,将a?mol?NH4NO3溶于水,溶液显酸性,原因是______(用离子方程式表示).向该溶液滴加b?L?氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为______mol?L-1.(NH3?H2O的电离平衡常数取Kb=2×10-5?mol?L-1)
参考答案:(1)反应(I)中,N2O4(l)中N元素得电子化合价降低,所以N2O4(l)是氧化剂,故答案为:氧化剂;
(2)升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是吸热反应,故答案为:吸热;
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol N2O4充入一恒压密闭容器中;
a、密度等于质量除以体积,平衡体系质量不变,反应体积增大,密度在反应过程中不变,说明反应达到平衡,故a符合;
b、反应的焓变和反应物与生成物能量总和之差计算,与平衡无关,故b不符合;
c、图象制表示正反应速率变化,不能证明正逆反应速率相同,故c不符合;
d、N2O4(l)转化率不变,证明反应达到平衡,故d符合;
示意图正确且能说明反应达到平衡状态的是ad;K=c2(NO2)c(N2O4),化学平衡常数只与温度有关,与物质的浓度无关,所以平衡常数K不变;v(NO2)=△c△t=0.6mol1L3s=0.2mol/L.s,则v(N2O4)=12v(NO2)=0.1mol/L.s;
故答案为:ad;不变;0.1;
(4)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性,是因为铵根离子水解;反应的离子方程式为:NH4++H2O?NH3?H2O+H+;加入氨水溶液抑制铵根离子水解,平衡逆向进行;将a mol NH4NO3溶于水,向该溶液滴加b L 氨水后溶液呈中性,溶液中氢氧根离子浓度=10-7mol/L;NH3?H2O的电离平衡常数取Kb=2×10-5 mol?L-1,设混合后溶液体积为1L,根据一水合氨电离平衡得到:NH3?H2O?NH4++OH-,平衡常数K=c(NH4+)c(OH-)c(NH3?H2O)=bmol/L×10-7mol/Lb×c(NH3?H2O)mol/L=2×10-5 mol?L-1,计算得到c(NH3?H2O)=a200bmol/L,
故答案为:NH4++H2O?NH3?H2O+H+;逆向;a200b.
本题解析:
本题难度:一般