时间:2025-06-26 03:42:44
1、计算题 (10分)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。则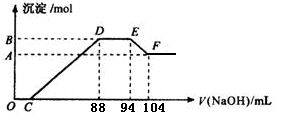
⑴B与A的差值为?mol。
⑵C点对应的溶液体积为?mL。
⑶原硝酸溶液中含硝酸的物质的量为?mol。
⑷铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为?。
⑸写出铝与该浓度硝酸反应的离子方程式?。
参考答案:⑴0.05 ⑵40? ⑶0.5? ⑷5:3?
⑸8Al+30H++3NO3-=8Al3++3NH4++9H2O
本题解析:由题意知,金属与硝酸反应时,硝酸的还原产物为NH4NO3,由图又可看出金属与硝酸反应后,硝酸是过量的,故金属的氧化产物为Fe(NO3)3、Al(NO3)3。图中:①0→C:H++OH-=H2O;②C→88:R3++3OH-=R(OH)3↓(R代表Fe或Al);③88→94:NH4++ OH-=NH3?H2O;④94→104:Al(OH)3+ OH-=AlO2-+ 2H2O。由④知n[Al(OH)3]=0.01L×5mol·L-1="0.05" mol=n(Al),此值也是B与A的差值。由③知,n(NH4NO3)=0.006L×5mol·L-1=0.03mol,根据反应中得失电子相等的原则得:3n(R3+)="0.03×8=0.24" mol,则n(R3+)="0.08" mol=n(合金),故混合物中n(Al):n(Fe)=5:3。0→88mL中,用于沉淀金属离子的OH-有0.08 mol×3="0.24" mol,故C点:(0.088L×5 mol·L-1-0.24 mol)÷5 mol·L-1=0.04L,即40mL。
本题难度:一般
2、选择题 下列图像能正确反映所对应实验的是? (? )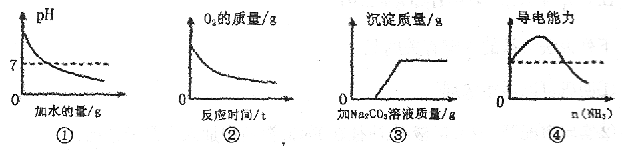
A.①为向pH=13的NaOH溶液中不断加水
B.②为向MnO 中加入一定量的H
中加入一定量的H O
O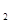 溶液
溶液
C.③为向CaCl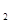 和盐酸的混合溶液中滴加Na
和盐酸的混合溶液中滴加Na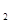 CO
CO 溶液
溶液
D.④为将氨气通人醋酸溶液中
参考答案:C
本题解析:A、碱加水稀释,不可能变成酸,错误;
B、产生氧气的量不断增加;
C、先与盐酸反应,后与氯化钙反应,正确;
D、导电能力一直最强,最后几乎不变。
本题难度:一般
3、选择题 能使水的电离平衡正向移动,而且所得溶液呈酸性的是
A.将水加热到100 ℃时,水的pH=6
B.向水中滴加少量稀H2SO4
C.向水中加入少量NaHCO3
D.向水中加入少量胆矾晶体
参考答案:D
本题解析:水是弱电解质,电离方程式是H2O H++OH-。所以酸或碱是抑制水的电离平衡的,能够水解的盐是促进水的电离的。据此可知,选项D正确,A是促进水的电离,溶液显中性。B是抑制水的电离,溶液显酸性。C是促进水的电离,溶液显碱性。硫酸铜是强酸弱碱盐,水解显酸性,答案选D。
H++OH-。所以酸或碱是抑制水的电离平衡的,能够水解的盐是促进水的电离的。据此可知,选项D正确,A是促进水的电离,溶液显中性。B是抑制水的电离,溶液显酸性。C是促进水的电离,溶液显碱性。硫酸铜是强酸弱碱盐,水解显酸性,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是明确水的电离特点,然后结合题意和勒夏特列原理灵活运用即可,有利于培养学生的创新思维能力和逻辑推理能力。
本题难度:一般
4、选择题 下列热化学方程式中,△H能正确表示物质的燃烧热的是
A.2CO(g) +O2(g) =2CO2(g) △H="-566.0" kJ/mol
B.C(s) +1/2O2(g) =CO(g) △H="-110.5" kJ/mol
C.CH4(g) +2O2(g)=CO2(g)+2H2O(l) △H="-890.31" kJ/mol
D.2C8H18(l) +25O2(g)=16CO2(g)+18H2O(l) △H="-11036" kJ/mol
参考答案:C
本题解析:燃烧热是指1mol物质完全燃烧生成稳定化合物时放出的热量,A中可燃物是2mol,不符;B中生成的CO不是稳定化合物,不符;C中符号定义,D中可燃物是2mol,不符;选C。
考点:考查燃烧热的定义。
本题难度:一般
5、选择题 将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是(?)
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol/L
D.该实验表明有水生成的反应都是放热反应
参考答案:B
本题解析:A项:由图像可知当 HCl溶液10ml时,中和后溶液的温度为22℃,所以环境温度应该小于22℃。C项:当HCl溶液30ml时,两溶液恰好中和,可推出NaOH溶液的浓度约是1.5 mol/L;
本题难度:一般