时间:2025-06-26 03:41:54
1、选择题 下列气体能用启普发生器制取的是
[? ]
A.O2?
B.C2H4
C.C2H2?
D.H2
2、简答题 (Ⅰ)甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答问题: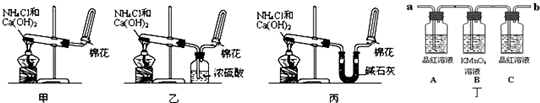
(1)甲、乙、丙三位同学制取氨气的化学方程式为:______.
(2)他们都用向下排空气法收集氨气,其原因是______.
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是______(填“甲”、“乙”或“丙”).
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论):______.
(5)三位同学都认为自己的实验装置还可用于加热碳酸氢铵固体来制取纯净的氨气,你判断能够达到实验目的是______(填“甲”、“乙”或“丙”),该装置中的NH4HCO3固体能否用NH4Cl固体代替?______(填“能”或“不能”).
(Ⅱ)已知二氧化硫可使高锰酸钾溶液褪色.反应的化学方程式为:
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
如图丁为验证浓硫酸与木炭在加热条件下,反应产物中是否含有SO2和CO2的部分装置.
(1)实验时,从______端连接盛有澄清石灰水的实验装置(用a或b填空).
(2)可观察到A瓶的溶液______.
(3)C瓶溶液的作用是______.
3、选择题 下列制备和收集气体的实验装置合理的是?
[? ]
A.用氯化铵制NH3 ?
?
B.用铜片和稀硝酸制NO?  ?
?
C.用锌粒和稀硫酸制H2? ?
?
D.用双氧水和二氧化锰制O2
4、实验题 甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与研究,并回答有关问题
(1)三位同学所用化学药品制取氨气的化学方程式为_________________________。
(2)三位同学都用向下排空气法而不用其他实验室常用方法收集氨气,其原因是________________。
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气,如果他的实验操作都正确,你认为没有收集到氨气的同学是_________(填“甲”、“乙”或“丙”),收集不到氨气的主要原因是
___________________________。
(4)你检验氨气是否收集满的方法是(简述操作方法、现象和结论)___________________________。
(5)三位同学都认为他们的实验装置也可用加热碳酸氢铵固体制取氨气,你判断他们能够达到实验目的的是_____(填“甲”、“乙”或“丙”),其理由是___________________________。
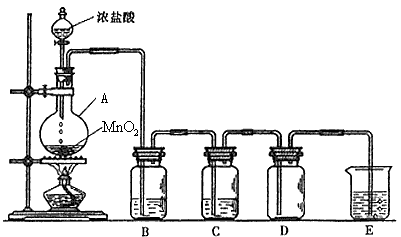
5、实验题 实验室用浓盐酸和二氧化锰反应制取纯净、干燥的氯气(氯化氢极易溶于水),装置如下图所示: