时间:2025-06-26 03:41:07
1、选择题 某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子的物质的量浓度之比为1:1:6。下列有关该溶液的判断正确的是
[? ]
A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变
B.向该溶液中滴加稀NaOH溶液,立即出现白色沉淀
C.若溶液中c(Cl-)=0.6 mol/L,则该溶液的pH为1
D.向该溶液中加入过量铁粉,只发生置换反应
参考答案:C
本题解析:
本题难度:一般
2、填空题 铝及其化合物在生产生活中的应用非常广泛。铝合金材料的防腐、含铝食品或药品的使用等问题都备受关注。 
(1)铝的阳极氧化是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中模拟该生产过程,实验装置如图所示。实验时接通开关K,通电约25min。在阳极生成氧化铝,阴极产生气体。写出该过程中的电极反应式:阳极:________________;
阴极:__________________。断开电路,取出铝片,用1%的稀氨水中和表面的酸液,再用水冲洗干净。写出该过程发生反应的离子方程式:________________。
(2)胃舒平(含有氢氧化铝)、平达喜都是常见的胃药。平达喜的化学成分是铝和镁的碱式碳酸盐。某化学兴趣小组通过以下实验探究该药物主要成分的化学式:甲同学取该碱式碳酸盐9.03 g充分灼烧至恒重, 测得剩余固体质量为5.13 g。乙同学取相同质量的碱式碳酸盐,使其溶于足量的盐酸中,收集到气体的 体积为336 mL(已换算成标准状况下);继续向其中加入足量的NaOH溶液,得到5.22 g白色沉淀。试通过计算确定该碱式碳酸盐的化学式(写出计算过程)。
参考答案:(1)2Al+3H2O-6e-=Al2O3+6H+;6H++6e-=3H2↑;NH3·H2O+H+=NH4++H2O?
(2)该碱式碳酸盐分解生成的水和CO2的总质量为9.03g-5.13g=3.9g,n(CO2)=0.015mol,m(CO2)=0.66g,
m(H2O)=3.9g-0.66g=3.24g,n(H2O) =0. 18mol。
该碱式碳酸盐受热分解所得到的固体是MgO和Al2O3的混合物。
n(MgO)=n[Mg(OH)2]=5.22g÷58g/mol=0. 09mol,m(MgO)=3.6g
m(Al2O3)=5.13g-3.6g=1.53g,n(Al2O3)=0.015mol
n(MgO):n(Al2O3):n(CO2):n(H2O)=0.09mol:0. 015mol:0. 015mol:0. 18mol=6:1:1:12,
所以该碱式碳酸盐的化学式为Mg6Al2(OH)16CO3·4H2O。
本题解析:
本题难度:一般
3、计算题 向Fe2O3固体粉末中加入200mL 3mol/L的盐酸,固体粉末恰好完全溶解。向所得溶液中加入一定量铁粉,此时向溶液中滴加KSCN溶液,无明显现象。试计算:
(1)Fe2O3的物质的量是多少?
(2)加入铁粉的质量至少为多少?
参考答案:(1)0.1mol
(2)5.6g
本题解析:
本题难度:一般
4、填空题 用于金属焊接的某种焊条,其药皮由大理石、水泥、硅、铁等配制而成。
(1)Al的原子结构示意图为______________;Al与NaOH溶液反应的离子方程式为____________________
(2)30Si的原子的中子数为_________;SiO2的晶体类型为__________________
(3)Al3+与Yn-的电子数相同,Y所在族的各元素的氮化物的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是__________。
(5)经处理后的熔渣36.0g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0g固体;滤液中加入过量NaOH溶液,分离得到21.4g固体;则此熔渣中Al2O3的质量分数为__________________。
参考答案:(1) 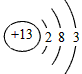 ;2Al+2OH-+2H2O===2AlO2-+3H2↑
;2Al+2OH-+2H2O===2AlO2-+3H2↑
(2)16;原子晶体
(3)HCl
(4)CO2
(5)25%
本题解析:
本题难度:一般
5、选择题 等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是
[? ]
A.2 mol·L-1 H2SO4溶液
B.18 mol·L-1 H2SO4溶液
C.6 mol·L-1 KOH溶液
D.3 mol·L-1 HNO3溶液
参考答案:A
本题解析:
本题难度:一般