时间:2025-06-26 03:33:47
1、填空题 从①Ba(OH)2 ②HCl ③Zn ④CuSO4 ⑤CaCO3中选出合适的物质,实现下列各题要求的变化,写出化学反应的化学方程式,是离子反应的写出离子方程式。
(1)实验室制取CO2的反应
(2)实验室制取H2的反应
(3)生成沉淀的反应
(4)盐与金属的置换反应
(5)酸碱之间的中和反应
参考答案:(10分,每空2分) (1)CaCO3 +2H+ =Ca2+ + CO2↑+H2O
(2)Zn+2H+ = Zn2++H2↑ (3)Ba2+ + 2OH- + Cu2+ +SO42+= BaSO4 ↓+ Cu(OH)2 ↓
(4)Zn+ Cu2+ = Cu+ Zn2+ (5)H+ + OH- = H2O
本题解析:(1)实验室制取CO2需要的试剂是碳酸钙和盐酸,该反应是离子反应,方程式是CaCO3 +2H+ =Ca2+ + CO2↑+H2O。
(2)实验室制取H2需要的试剂是锌互为盐酸,该反应是离子反应,方程式是Zn+2H+ = Zn2++H2↑ 。
(3)硫酸铜和氢氧化钡反应可以生成沉淀,该反应是离子反应,方程式是生成沉淀的反应Ba2+ + 2OH- + Cu2+ +SO42+= BaSO4 ↓+ Cu(OH)2 ↓。
(4)锌和硫酸铜发生置换反应,该反应是离子反应,方程式是Zn+ Cu2+ = Cu+ Zn2+。
(5)酸碱之间的中和反应是离子反应,反应的离子方程式是H+ + OH- = H2O。
考点:考查离子反应方程式的判断和书写
点评:该题是基础性试题的考查,试题注重基础,侧重对基础知识的巩固与训练,有利于培养学生的逻辑思维能力和应试能力,提高学生的规范答题能力和学习效率。该题的关键是明确离子反应的含义以及发生的条件和书写的原则。
本题难度:一般
2、选择题 下列离子方程式书写正确的是
A.用铜片作阴、阳极电解硝酸银溶液:4Ag +2H2O
+2H2O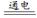 4Ag+O2↑+4H
4Ag+O2↑+4H
B.向Na2SO3、NaI的混合溶液中滴加少量氯水:2I—+C12="=2" Cl—+I2
C.向水杨酸中加入适量Na2CO3溶液: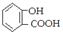 +CO32- →
+CO32- →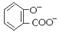 +CO2↑+H2O
+CO2↑+H2O
D.AgCl沉淀在氨水中溶解:AgCl+2NH3·H2O ==Ag(NH3)2++Cl-+2H2O
参考答案:D
本题解析:A项,书写正确;B项,氯气先于亚硫酸根反应,亚硫酸根的还原性强于碘离子;C项,Na2CO3溶液的酸性弱于苯甲酸的酸性,但强于苯酚的酸性,故酚羟基上的氢不能脱去。故正确选项为D。
考点:离子方程式的书写
点评:本题属于常规体型,这些离子方程式的书写,包括电解反应,氧化还原反应,酸的置换反应,络合反应,考查内容较多,题目难度较大,注意书写细节。
本题难度:困难
3、选择题 下列方程式中不正确的是
A.Fe与FeCl3溶液反应:Fe + 2Fe3+ = 3Fe2+
B.Cl2与NaOH溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
C.氢氧化钡溶液与硫酸反应:Ba2++SO42-=BaSO4↓
D.醋酸和氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O
参考答案:C
本题解析:试题分析:氢氧化钡与稀硫酸的反应除了Ba2+与SO42-反应以外,H+和OH-也要发生反应,所以反应方程式为2OH-+Ba2++2H++SO42-=BaSO4↓+2H2O。所以选C。
考点:离子反应方程式
点评:离子方程式正误判断要注意:看是否符合客观事实、看是否符合质量守恒、看是否符合电荷守恒、看是否符合得失电子相等。可溶的易电离的物质拆成离子。注意过量、少量、适量等。
本题难度:困难
4、选择题 能正确表示下列化学反应的离子方程式的是
A.小块金属钠投入水中:2Na+2H2O = 2Na++2OH-+H2↑
B.铝片投入氢氧化钠溶液中:2Al+2OH-= 2AlO2-+3H2↑
C.硫酸铝与氨水反应:Al3+ + 3OH- = Al(OH)3↓
D.H2SO4溶液中滴入Ba(OH)2溶液:Ba2++OH-+H++SO42-= BaSO4↓+H2O
参考答案:A
本题解析:略
本题难度:困难
5、选择题 下列离子方程式正确的是
A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O
B.氯乙酸与氢氧化钠溶液共热:CH2ClCOOH+OH- →CH2ClCOO-+H2O
C.苯与浓硫酸、浓硝酸的混合液共热制硝基苯: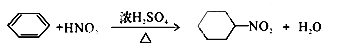
D.用银氨溶液检验乙醛中的醛基:CH3CHO +2[Ag(NH3)2]++2OH-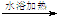 CH3COO-+NH4+ +3NH3+2Ag↓+ H2O
CH3COO-+NH4+ +3NH3+2Ag↓+ H2O
参考答案:D
本题解析:A中醋酸是弱酸,要写化学式不能写离子形式,错;B中氯乙酸中Cl在氢氧化钠溶液中会发生水解反应,错误;C中把苯环写错了,错;D正确。
考点:有机物中的离子方程式的正误判断。
本题难度:一般