时间:2025-06-26 03:33:47
1、选择题 下列表示对应化学反应的离子方程式错误的是
A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+6H+=3I2+3H2O
B.向甲酸溶液中加入KOH溶液:HCOOH+OH-=HCOO-+H2O
C.将过量CO2通入冷氨水中:CO2+NH3?H2O=HCO3-+NH4+
D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O
2、选择题 下列图示与对应的叙述相符的是
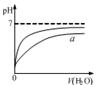
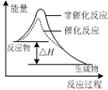

图甲 图乙 图丙 图丁
A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B.图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C.图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D.图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
3、填空题 化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是(填化学式) 。
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式 、 。
4、选择题 向混合溶液中滴加0.1 mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。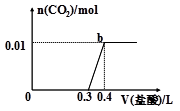
下列对溶液中溶质组成成分判断正确的是
A.原溶液中溶质为Na2CO3和NaHCO3
B.原溶液中溶质为 NaOH和Na2CO3
C.原溶液中溶质为Na2CO3
D.原溶液中溶质为NaHCO3
5、填空题 已知铜在常温下能被稀HNO3溶解:3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O
⑴请将上述反应改写成离子方程式:_________________________________(2分)
⑵上述反应中氧化剂是______,氧化产物是______,在反应的硝酸中,没有参加氧化还原反应的硝酸占总硝酸的__ ____(2分)