时间:2025-06-26 03:23:55
1、选择题 化学与工农业生产、环境保护、日常生活等方面有广泛联系,下列叙述正确的是
A.纯净水几乎不含任何杂质,喝纯净水比喝矿泉水对人体更有营养
B.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅
C.雨水样品一段时间后,pH由4.68变为4.28,是因为雨水中溶解了较多的氮氧化物和CO2
D.二氧化硫的大量排放是造成酸雨和光化学烟雾的主要原因
参考答案:B
本题解析:
分析:A、纯净水加工时,在去除水中的污染物的同时也去除了水中人体必需的微量元素和宏量元素.水是人体获取矿物质的重要途径,在特殊情况条件下还是主要来源.经常和纯净水会导致人体缺乏人体需要的无机盐以及一些微量元素;
B、二氧化硅常用作光导纤维;
C、酸雨中亚硫酸为弱电解质,具有还原性,能被氧化成强电解质硫酸,溶液的PH减小;
D、光化学烟雾由碳氢化合物和氮氧化合物在阳光的作用下起化学反应所产生.
解:A、纯净水不含人体所需的无机盐,应多喝矿泉水或自来水来补充,故A错误;
B、光纤实际是指由透明材料做成的纤芯和在它周围采用 比纤芯的折射率稍低的材料做成的包层,并将射入纤芯的光纤的光信号,经包层界面反射,使光信号在纤芯中传播前进的媒体.这种透明材料主要成分就是SiO2,故B正确;
C、饱和CO2溶液的PH等于5.6,而雨水的pH由4.68变为4.28,是因为2H2SO3+O2═2H2SO4,故C错误;
D、大气中碳氢化合物和氮氧化合物在阳光的作用下起化学反应所产生的化学污染物,故D错误;
故选B.
本题难度:一般
2、实验题 长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定亚硫酸钠试剂被氧化的程度,设计了下图实验,请回答下面的问题: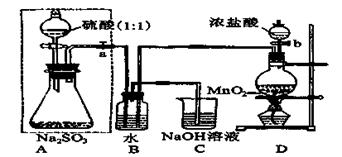
(1)D装置中反应的化学方程式为?。
B装置中反应的离子方程为?。
(2)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应、过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为:?。
(3)为保证实验测定的准确性,A中的硫酸什么时候滴加?,
C装置中NaOH溶液的作用是 _________________。
(4)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,请从中选择合适试剂,设计一种不同的实验方法,测定试样中无水亚硫酸钠被氧化的程度,你使用试剂的顺序为:?。(填试剂编号)
参考答案:(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O?(3分)?Cl2+SO2+2H2O==4H++2Cl-+SO42-?(3分)
MnCl2+Cl2↑+2H2O?(3分)?Cl2+SO2+2H2O==4H++2Cl-+SO42-?(3分)
(2)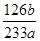 ×100% (2分)
×100% (2分)
(3)待B中水面上方充满了黄绿色的气体(2分) ?吸收尾气,防止污染大气?(2分)?
(4)①②④?(3分)
本题解析:(1)D为实验室制备氯气的发生装置,反应为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸,反应为:Cl2+SO2+2H2O═4H++2Cl-+SO42-。
MnCl2+Cl2↑+2H2O;氯气具有氧化性,二氧化硫具有还原性,在B中发生氧化还原反应生成盐酸和硫酸,反应为:Cl2+SO2+2H2O═4H++2Cl-+SO42-。
(2)根据硫元素守恒计算,得到的bg沉淀是BaSO4,根据Na2SO3—SO2—BaSO4,可知Na2SO3为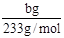 =?
=?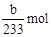 ,所以Na2SO3的质量分为数为
,所以Na2SO3的质量分为数为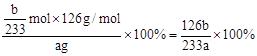 。
。
(3)保证实验的准确性就是不让SO2流失掉,所以硫酸应该在B中水面上方充满了黄绿色的气体的时候滴加;C中的NaOH溶液的作用是吸收尾气,防止氯气污染大气。
(4))另外一种设计方案是将Na2SO3溶于水,然后向其中加入稀盐酸至不再产生气体为止,在加BaCl2溶液,然后将生成的沉淀过滤洗涤干燥称量其质量,求出Na2SO4的质量分数,继而求得Na2SO3的质量分数。所以使用试剂的顺序是①②④。
本题难度:一般
3、选择题 在一定温度下,向55 g水中加入一定质量的无水Na2SO3粉末,充分搅拌过滤,得到60 g溶液和一定质量的Na2SO3·7H2O晶体。若此温度下Na2SO3的溶解度为20 g,析出Na2SO3·7H2O晶体的质量为
A.5 g
B.10 g
C.15 g
D.10.5 g
参考答案:B
本题解析:设60 g溶液中溶剂的质量为x g
则有:60∶(100+20)=x∶100
x=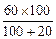 ="50" g
="50" g
Na2SO3·7H2O中含水55 g-50 g="5" g
析出Na2SO3·7H2O晶体的质量为
5 g× ="10" g
="10" g
本题难度:简单
4、选择题 下列叙述正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下不容易与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝、锌等金属钝化
参考答案:B
本题解析:浓硫酸使蔗糖炭化,是利用了浓硫酸的脱水性。浓硫酸虽然具有氧化性,但和铜反应时需要加热。氨气是一种碱性气体,不能用浓硫酸来干燥,可以用碱石灰来干燥氨气。在浓硫酸中发生钝化的是铁和铝,不是锌。答案选B。
本题难度:简单
5、填空题 写出下列反应的化学方程式,是离子反应的写离子方程式。
(1)少量SO2气体通入到NaOH溶液中:____________。
(2)过量SO2气体通入到澄清石灰水中:___________。
(3)SO2气体通入到碘水中:_____________________。
(4)H2S气体与SO2气体混合:___________________。
(5)SO2和O2的反应:__________________________。
(6)SO2气体通入到少量Na2CO3溶液中____________
参考答案:(1)SO2+2OH-
 +H2O
+H2O
(2)SO2+OH-
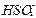
(3)SO2+I2+2H2O
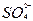 +2I-+4H+
+2I-+4H+
(4)2H2S+SO2 3S↓+2H2O
3S↓+2H2O
(5)2SO2+O2 2SO3
2SO3
(6)2SO2+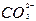 +H2O
+H2O CO2↑+
CO2↑+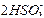
本题解析:(1)SO2少量,生成正盐。(2)SO2过量,生成酸式盐。(3)SO2表现还原性。(4)SO2表现氧化性。(6)SO2过量,生成酸式盐,酸性H2SO3>H2CO3,故生成CO2。
本题难度:简单