时间:2025-06-26 03:23:55
1、选择题 将SO2气体徐徐通入悬浮着棕色PbO2的热水中,一段时间后,将发生的现象是
A.悬浮物消失,溶液无色
B.悬浮物由棕色变白色
C.有臭鸡蛋气味的气味逸出
D.析出浅黄色沉淀
参考答案:B
本题解析:
铅的+2价化合物稳定,故PbO2具有强氧化性,易得电子发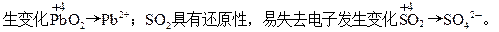
在溶液中的反应为Pb2+?+SO42-=PbSO4↓(白色)。
本题难度:一般
2、选择题 关于1 mol·L-1的硫酸溶液的下列叙述,不正确的是()
A.1 L该溶液中含溶质98 g
B.从10 mL该溶液中取出5 mL后,剩余溶液浓度仍为1 mol·L-1
C.将4.9 g浓硫酸加入盛有50 mL蒸馏水的烧杯中,充分混合就可配得该浓度的硫酸溶液
D.该浓度的硫酸具有酸的通性,但不具有强氧化性
参考答案:C
本题解析:配制1 mol·L-1的硫酸应取含4.9 g纯硫酸的浓硫酸稀释成50 mL溶液。
本题难度:简单
3、选择题 臭氧(O3)可使湿润的KI淀粉试纸变蓝,反应为KI+O3+H2O KOH+I2+O2(未配平),由此可得出下列结论正确的是( )?
KOH+I2+O2(未配平),由此可得出下列结论正确的是( )?
A.O3在反应中被氧化为O2?
B.O3的氧化能力大于O2?
C.1 mol O3在反应中得到2 mol电子?
D.反应中氧化产物O2与还原产物I2的物质的量之比为1∶1
参考答案:C
本题解析:反应配平后:2KI+O3+H2O====2KOH+I2+O2
还原剂为I-,氧化剂为O3中的1个氧原子。
A中说O3在反应中被氧化,是错误的。
B中O3比O2的氧化能力大的说法是正确的,如Ag、Hg在空气或氧气中不易被氧化的金属,可以与臭氧发生反应。但在本题中由于O2的化合价没有改变,它既不是氧化产物也不是还原产物,故得出O3的氧化能力大于O2是不正确的。C项正确。D项不正确,O2不是氧化产物。
本题难度:简单
4、选择题 下列物质均有漂白作用,但其中一种的漂白原理与其他三种不同的是(? )
A.HClO
B.SO2
C.O3
D.Na2O2
参考答案:B
本题解析:SO2的漂白作用,实质上是SO2与有机色质化合生成无色物质,其他三者均是表现强氧化性,将有机色质氧化成无色物质。
本题难度:简单
5、实验题 长期存放的亚硫酸钠可能会被部分氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度。实验步骤如下:
①称量ag样品,置于烧杯中。
②加入适量蒸馏水,使样品溶解。
③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液。
④过滤,用蒸馏水洗涤沉淀。
⑤加热干燥沉淀物。
⑥将沉淀物冷却至室温后,称量。
⑦重复⑤、⑥操作直到合格,最后得到b g固体。
回答下面问题:?
(1)本实验中是否能用Ba(NO3)2代替BaCl2?__________;其理由是?。
(2)步骤③中加盐酸使溶液呈强酸性的目的是?。
(3)步骤⑦的“合格”标准是:?。
(4)实验测得样品中无水亚硫酸钠占原有样品的质量分数是?。(列出算式.不需化简)
参考答案:
(1)不能
在酸性溶液中,NO3-能将SO32-氧化成SO42-,造成结果错误。
(2)保证得到的沉淀都是BaSO4,没有BaSO3。
(3)连续两次称量的质量不变
(4)(a g-142 g·mol-1× )×
)× ×100%
×100%
本题解析:
Na2SO3容易被空气中的O2氧化为Na2SO4,但a g样品配成溶液加入HCl后,Na2SO3已经转化为SO2,再加BaCl2就只得BaSO4沉淀。通过BaSO4的质量b g求出变质生成的Na2SO4的质量即可。
具体的操作及设问均围绕不使Na2SO3沉淀及精确称量沉淀的质量展开,在注意原理分析的同时也要注意实验技巧的分析。
本题难度:简单