时间:2025-06-26 03:23:06
1、填空题 (16分)某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。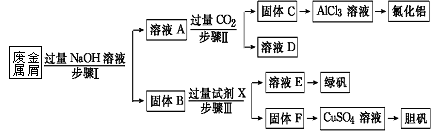
请回答:
(1)写出步骤Ⅰ反应的离子方程式: ; 。
(2)试剂X是 。由溶液D是 。
(3)在步骤Ⅱ时,用如图装置制取CO2并通入溶液A中。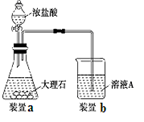
一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
(4)溶液E中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因 。
(5)用固体F继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;写出反应的化学方程式 ,
(6)工业上常用溶液E经进一步处理可制得净水剂Na2FeO4,流程如下: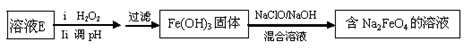
①测得溶液E中c(Fe2+) 为0.2 mol·L-1,若要处理1 m3溶液E,理论上需要消耗25 % 的H2O2溶液___kg。
②写出由Fe(OH)3制取Na2FeO4的离子方程式___________。
2、选择题 下列反应的离子方程式正确的是BD
A.氨气通入盐酸溶液 HCl+NH3 ="=" NH4Cl
B.澄清的石灰水跟盐酸反应 H++OH- ="=" H2O
C.碳酸钡溶于醋酸 BaCO3+2H+ ="=" Ba2++H2O+CO2↑
D.金属钠跟水反应 Na+2H2O ="=" Na++2OH-+H2↑
3、计算题 (10分)完成下列离子方程式
(1)硫酸酸化的高锰酸钾溶液与草酸反应
(2)硫代硫酸钠与硫酸反应
(3)硫酸溶液与淀粉碘化钾溶液混合在空气中放置一段时间
(4)K2Cr2O7的溶液中存在的平衡
(5)氯化铁与硫氰化钾溶液反应
4、填空题 【化学——选修2化学与技术】(15分)
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。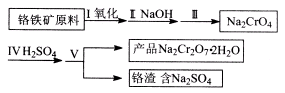
①步骤I中反应的化学方程式为:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2= 8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为 。在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
A.升高温度
B.通入过量的空气
C.将原料粉碎
D.增加纯碱的用量
②步骤II中所得溶液显碱性,其中除含有Na2C rO4外还含有铝、硅元素的化合物,它们的化学式可能是 。
③步骤III需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为:____。
(2)将红矾钠与KC1固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体,反应方程式为:Na2CrO4 +2KCl= K2Cr2O7 +2NaCl(已知NaCl的溶解度受温度影响小,K2Cr2O7的溶解度受温度影响大),基本实验步骤为:①溶解;② ;③____ 。
④冷却、结晶,过滤,得到K2Cr2O7晶体。
5、实验题 (10分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ、测定过氧化氢的含量
请填写下列空白:
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
(3)滴定时,将高锰酸钾标准溶液注入 (填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是 。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为 。