时间:2025-06-26 03:13:19
1、选择题 X、Y、Z三种原子序数依次增大的短周期元素,X、Y同族,Y、Z同周期.X原子的最外层电子数是其电子层数的2倍.下列说法正确的是( )
A.氢化物中共价键数目Z<X
B.Z元素最高价氧化物对应水化物的化学式为H2ZO3
C.物质的量浓度相同的Na2XO3和Na2YO3溶液,pH后者大于前者
D.含氧酸的酸性X<Z
参考答案:由题中信息可知X为C,Y为Si,Z可能为P、S、Cl等元素,则
A.X为C,最外层电子数为4,1个C原子最多可形成4的共价键,可形成共价键数目较多的烃类物质,故A正确;
B.Z可能为P、S、Cl等元素,对应的最高化合价为+5、+6、+7,而H2ZO3中Z的化合价为+4价,故B错误;
C.X为C,Y为Si,非金属性C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则对应的强碱盐碱性越弱,则物质的量浓度相同的Na2XO3和Na2YO3溶液,pH后者大于前者,故C正确;
D.由于对应的含氧酸不一定为最高价含氧酸,则无法比较酸性强弱,故D错误.
故选AC.
本题解析:
本题难度:一般
2、选择题 下列有关说法不正确的是
A.能使品红试液褪色的气体不一定是SO2
B.胶黏剂UF结构为: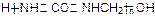 ,可推测其单体为尿素和甲醇
,可推测其单体为尿素和甲醇
C.CO2电子式为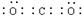
D.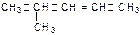 命名为4-甲基-2-戊烯
命名为4-甲基-2-戊烯
参考答案:B
本题解析:A:能使品红溶液褪色的气体有:Cl2、O3、SO2等。
B:单体为尿素和甲醛。
C、D正确。
本题难度:一般
3、填空题 2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备。请回答下列问题:
(1)O、S、Se的电负性最小的是?,它们的氢化物中沸点由高到低的顺序是?(用化学式表示)。
(2)硒的低价含氧酸盐—亚硒酸钠(Na2SeO3),能促进细胞DNA的增殖活性,延缓细胞衰老,SeO32-中的Se原子杂化方式是?,空间构型为?;
(3)镉(Cd)与锌为同族相邻元素,在周期表中Cd位于?区,Cd 的最外层电子排布图是?。
(4)锌单质晶体是六方最密堆积,原子按?(填“ABABAB”或“ABCABCABC”)的方式堆积而成,晶体中Zn原子的配位数为?,锌易与某些小分子物质形成配合物,在[Zn(NH3)4]2+离子中提供孤电子对的原子是?(填元素符号)。
(5)镉和锌都是电的良导体,非金属晶体石墨也具有良好的导电性,下图为石墨晶体结构示意图及提供的资料,12g石墨晶体中正六边形的数目为?,石墨的密度为?g·cm-3。(阿伏加德罗常数为NA)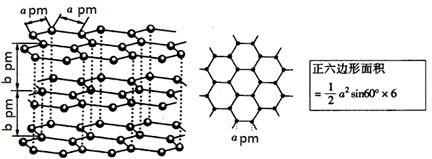
参考答案: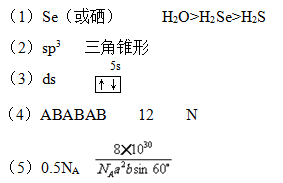
本题解析:(1)同一主族从上到从非金属逐淅减弱,电负也减弱,Se的电负性最小;H2O分子之间形成氢键,其它分子间是范德华力,因而沸点由高到低排列是H2O、H2Se、H2S。
(2)SeO32-中硒原子中孤电子对数=(6+2-3×2)/2=1,所以Se采取的是sp3杂化,空间构型是三解锥形。
(3)Zn位于第四周期 ⅡB,属于ds区。所以同族的镉位于ds区,最外层电子排布图是 。
。
(4)Zn是六方最密积堆积,ABABAB,晶体中Zn的配位数是12。在[Zn(NH3)4]2+离子中提供孤电子对的原子是N。
(5)在石墨的结构中,一个碳原子归三个六边形所有,所以一个六边形平均点有1/3个碳原子,一个六边形有6个这样的碳原子,故一个六边形平均点有2个碳原子。12g石墨含有六边形是1mol×NA/2=0.5NA。由于由于层与层可滑动,抽象出一个正六棱柱,一个六棱柱体积=1/2(6a2bsin600×10-30)cm3,密度=m/v=[2×12÷NA]÷[1/2(6a2bsin600×10-30)]=8×10-30/NAa2bsin600
本题难度:一般
4、选择题 下列化学用语正确的是( )
A.CO2的比例模型?
B.H2O2的电子式?
C.氨分子的结构式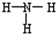
D.14C的原子结构示意图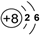
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列说法错误的是
[? ]
A.在共价化合物中一定含有共价键
B.含有离子键的化合物一定是离子化合物
C.含有共价键的化合物一定是共价化合物
D.双原子单质分子中的共价键一定是非极性键
参考答案:C
本题解析:
本题难度:简单