时间:2025-06-26 03:09:13
1、选择题 共价健、离子键、金属键、分子间作用力都是微粒间的作用力,含有以上两种作用力的晶体是……( )
A.SiO2
B.CCl4
C.NaCl
D.金刚石
参考答案:B
本题解析:SiO2只含共价键,NaCl只含离子键,金刚石只含共价键,而CCl4是分子晶体,含共价键和分子间作用力。
本题难度:一般
2、填空题 决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示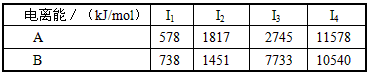
A的化合价____(填“>”“<”或“=”)B的化合价。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如左下图所示),其中3种离子晶体的晶格能数据如下表: 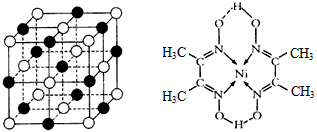
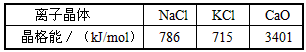
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:________。 其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有____个。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是____________。
(4)某配合物的分子结构如上图(右)所示,则N原子的杂化方式为__________;基态Ni原子的电子排布式___________。
参考答案:(1)>
(2)TiN>MgO>CaO>KCl;12
(3)CrO2
(4)sp2;[Ar]3d84s2
本题解析:
本题难度:一般
3、填空题 (6分)一种离子晶体的晶胞如右图其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示。
表示。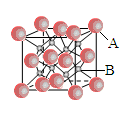
(1)每个晶胞中含A离子的数目为________,含B离子数目为________。
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是___________________;
(3)阳离子周围距离最近的阴离子数为_____,阴离子周围距离最近的阳离子数_____。
(4)已知A的离子半径为r m,则该晶胞的体积是 ___________m3。
参考答案:(6分,每空1分)(1)4、8?(2)CaF2?(3)8、4?(4)16r3
本题解析:(1)根据晶胞结构可知,B请别再晶胞内,共计是8个。而A离子的个数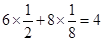 个。
个。
(2)根据(1)可知,该离子化合物的化学式是AB2。又因为A的核外电子排布与Ar相同,B的电子排布与Ne相同,则A是Ca,B是F,所以化学式是CaF2。
(3)根据晶胞结构可知,钙离子周围距离最近的阴离子F-数为8个,而阴离子周围距离最近的阳离子数4个。
(4)已知A的离子半径为r m,则该晶胞的面半径是4rm,所以晶胞的边长是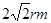 ,因此晶胞的体积是16r3。
,因此晶胞的体积是16r3。
点评:该题是中等难度的试题,也是高考中的重要考点和题型,试题综合性强,注重基础知识的巩固,侧重能力的培养和解题方法的指导与训练。有利于培养学生的逻辑推理能力和抽象思维能力。该题的关键是明确晶胞中离子个数的计算原则和依据,有利于提高学生分析问题、解决问题的能力。
本题难度:一般
4、选择题 下列晶体在溶于水或熔化时,破坏键的作用力完全相同的是(? )
A.干冰
B.KOH
C.NaHSO4
D.乙酸
参考答案:B
本题解析:物质的晶体在水中溶解时,某些离子键或共价键往往由于水分子而作用断开,生成相应离子。而晶体熔化时,只有原子晶体内的共价键可以被破坏,存在于离子晶体、分子晶体内的共价键不能被破坏。如NaHSO4在水中电离出Na+、H+和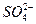 ,而在熔化时,只电离出Na+和
,而在熔化时,只电离出Na+和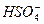 。
。
本题难度:简单
5、选择题 HgCl2稀溶液是外科手术刀的一种消毒剂。HgCl2有如下性质:①晶体熔点较低;②在熔融状态下不能导电;③在水溶液中可发生微弱电离,下列关于HgCl2的叙述中正确的是?(?)
A.HgCl2属于共价化合物
B.HgCl2属于离子化合物
C.HgCl2属于非电解质
D.HgCl2属于弱电解质
参考答案:
AD
本题解析:
因为HgCl2晶体熔点较低、熔融状态不导电,可知其为分子晶体,共价化合物。又因为HgCl2在水溶液中可发生微弱电离,可知HgCl2属于弱电解质。
本题难度:简单