时间:2025-06-26 03:07:35
1、填空题 钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、 Ba( FeO2)2等]。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下: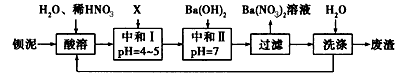
(1)酸溶后溶液的pH =1,Ba( FeO2)2与HNO3反应的化学方程式为________________ 。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是_____________。
(3)该厂结合本厂实际,选用的X为________(填化学式);中和I使溶液中_________ (填离子符号)的浓度减小(中和I引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是_____________。
参考答案:(1)Ba(FeO2)2+8HNO3=Ba(NO3)2十2Fe(?NO3)3+4H2O?
(2)防止反应速率过快、浓HNO3易挥发、分解(合理答案即可)?
(3)BaCO3 ;Fe3+、H+?
(4)减少废渣中可溶性钡盐对环境的污染(合理答案即可)
本题解析:
本题难度:一般
2、填空题 【三选一—选修化学与技术】
晶体硅可用作制芯片和太阳能电池等。下列流程图是工业上制取纯硅的一种方法。 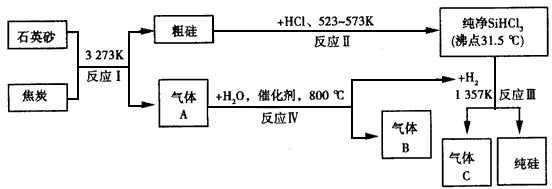
请回答下列问题(各元素用相应的元素符号表示)。
(1)在上述生产过程中,属于置换反应的有__(填反应的代号“I~Ⅳ”)。
(2)A、B、C三种气体在上述生产过程中可循环利用的是___;在“节能减排”中作为减排目标的一种气体是___。
(3)化合物甲的用途很广,有些已应用于高、精、尖科技领域。通常可作建筑工业和造纸工业上的黏合剂。将石英砂和纯碱按一定比例混合加热至1373~1 623 K反应生成化合物甲,其化学方程式为___。
(4)利用反应Ⅲ能制得纯硅的原因是___。
(5)已知反应Ⅳ中产物的总能量比反应物的总能量低,则在密闭容器内反应Ⅳ达到平衡,改变下列 条件,气体B的物质的量增大的是___。
a.缩小容器的容积
b.降低反应体系的温度
c.加入少量NaOH固体(生成物在此温度下不分解)
d.加入少量催化性能更好的催化剂
(6)金属镍(Ni)与气体A能形成常温下为液态的Ni(A)4、利用Ni(A)4的生成与分解可以制得纯度很高的纳米镍,写出Ni( A)4在423K时分解的化学方程式___。
参考答案:(1)I、Ⅱ、Ⅲ
(2)CO、HCl;CO2
(3)SiO2+Na2CO3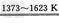 Na2SiO3+CO2↑
Na2SiO3+CO2↑
(4)反应体系中只有Si是固体,其他物质在1357?K下均为气体且在Si 中不溶解
(5)b
(6)Ni(CO)4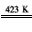 Ni+4CO↑
Ni+4CO↑
本题解析:
本题难度:一般
3、填空题 明矾石的主要成分是K2SO4·Al2(SO4)3·2Al?2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:? 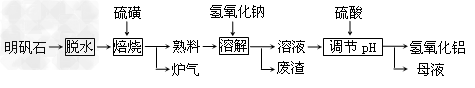
(1)“焙烧”过程中反应的化学方程式为2Al2(SO4)3+3S 2Al2O3?+_________;该反应的氧化剂是________;该反应中被氧化的元素与被还原的元素的质量比是________?。
2Al2O3?+_________;该反应的氧化剂是________;该反应中被氧化的元素与被还原的元素的质量比是________?。
(2)“溶解”时反应的离子方程式为____________。
(3)“调节pH后过滤、洗涤Al(OH)3沉淀,证明已洗涤干净的实验操作和现象是_____________。
(4)“母液”中可回收的物质是_____________。
(5)工业上常用氢氧化铝脱水后的产物X熔融电解冶炼金属铝,则该反应的化学方程式为_______________。
参考答案:(1)9SO2?;Al2(SO4)3;1∶2
(2)Al2O3+2OH-=2AlO2-+H2O
(3)取最后一次洗涤的滤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净。
(4)K2SO4?,?Na2SO4?
(5)2Al2O3?(熔融)? 4Al+3O2↑
4Al+3O2↑
本题解析:
本题难度:一般
4、填空题 硫酸铜在工农业生产中有着广泛的应用,用某种氧化铜矿制备硫酸铜的工艺流程如下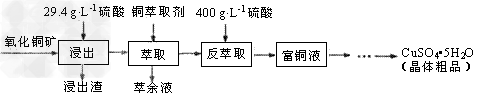
(1)浸出时所用硫酸的质量浓度(单位体积的溶液所含溶质的质量)为29.4g·L-1,其物质的量浓度是_____,浸出过程中反应的化学方程式是___________________。
(2)萃取“相比”是表示萃取效果的参数之一,指的是有机相(O)与水相(A)的体积比。采用一定浓度的铜萃取剂萃取硫酸浸出液中的铜离子,测得当萃取时间为120s时, “相比”(O/A)对铜萃取率的影响如图所示。在实际操作中“相比”应选择_______?。(填序号) 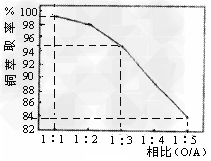
A.1:1?B.1:3?C.1:5
(3)已知铜萃取剂可用HR(O)表示,萃取过程可表示为:Cu2++2HR(O) CuR2(O)+2H+,反萃?取加入400?g/L?硫酸的理由是________________。
CuR2(O)+2H+,反萃?取加入400?g/L?硫酸的理由是________________。
(4)从富铜液中获得较多晶体粗品的实验操作依次是________、________(填操作名称)过滤、干燥。
(5)游泳场馆常用硫酸铜作杀菌剂,这是利用了CuSO4的?_________性质。
参考答案:(1)0.3mol·L-1;?CuO+H2SO4=CuSO4+H2O
(2)B
(3)增大c(H+)使平衡逆向移动,有利于铜离子反萃取(或其它合理答案)
(4)蒸发浓缩;冷却结晶
(5)可使蛋白质变性
本题解析:
本题难度:一般
5、实验题 医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下: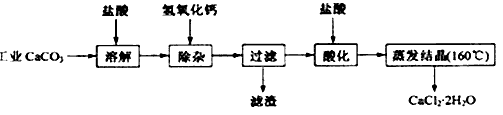
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~5.0,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是________________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,起目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③_______________________ 。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.0500 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
①上述测定过程中需用溶液润洗的仪器有____________________ 。
②计算上述样品中CaCl2·2H2O的质量分数为________________ 。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有______________;______________________ 。
参考答案:(1)取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3沉淀完全
(2)防止溶液吸收空气中的CO2
(3)①酸式滴定管;②99.9%; ③样品中存在少量的NaCl ;少量CaCl2·2H2O失水
本题解析:
本题难度:一般