时间:2025-06-26 03:07:35
1、填空题 新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2MSiO4(M=Mn、Fe、Co等)是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。下面列出了两种制备Li2FeSiO4的方法:
(1)固相法中制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是___________;根据已有信息,以下判断正确的是________________。
①该反应是氧化还原反应?
②该反应一定是吸热反应
③Li2SiO3?和Li2FeSiO4属于硅酸盐
(2)溶胶-凝胶法中,检验溶液中有胶体产生的方法是____________;实验中若制得1mol?Li2FeSiO4,整个反应过程中转移电子的物质的量为________________。
(3)以Li2FeSiO4、嵌有Li的石墨为电极,含Li+的导电固体为电解质的锂离子电池,充、放电的总反应式可表示为Li2FeSiO4 Li+LiFeSiO4,该电池放电时,负极是________,正极反应式为__________________。
Li+LiFeSiO4,该电池放电时,负极是________,正极反应式为__________________。
(4)三种Li2MSiO4的性能对比如下图所示。实际应用时,常用来源丰富的铁元素生产的
Li2FeSiO4作电极材料,使用该电极材料的另一个优点是___________________。 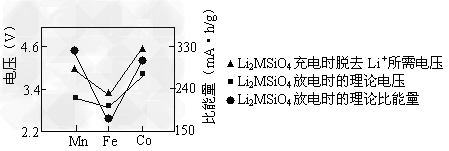
2、填空题 2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的,回收利用锂资源成为重要课题。某研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如下:
已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。 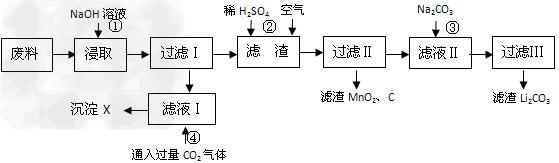
(1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是_______________。
(2)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求__________________________。
(3)写出反应④生成沉淀X的离子方程式:________________________?。
(4)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的化学反应方程式:_____________________________。
(5)生成Li2CO3的化学反应方程式为___________________。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应______________。
3、填空题 CoCl2·6H2O是一种饲料营养强化剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图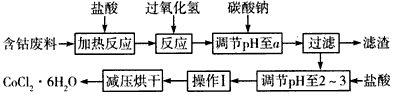
已知:
①钴与盐酸反应的化学方程式为Co+2HCl=CoCl2+H2↑。
②CoCl2·6H2O的熔点为86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表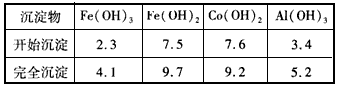
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点是
___________________
(2)加入碳酸钠调节pH至a,a的范围是_______________。
(3)操作I包含3个基本实验操作,它们是____________和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是______________________。
(5)为测定产晶中CoCl2·6H2O的含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是__________________。
(6)在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是_____________。
4、填空题 硫酸镁又名泻盐,是一种重要的无机化工产品,用途十分广泛。某化工厂从该厂的工业废渣(主要成分是MgCO3,另外还有CaCO3、SiO2等杂质)中提取回收MgSO4.7H2O的主要工艺流程如下。 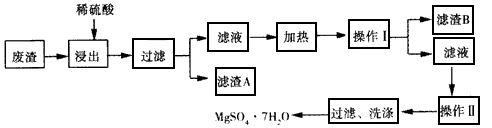
请仔细阅读所给内容,回答下列问题。
(1)滤渣B的主要成分的化学式为__________。
(2)操作I的名称是__________,如何检验滤渣A已经洗涤干净:_____________。
(3)写出废渣与稀硫酸反应的化学方程式___________。
5、填空题 【三选一—选修化学与技术】
晶体硅可用作制芯片和太阳能电池等。下列流程图是工业上制取纯硅的一种方法。 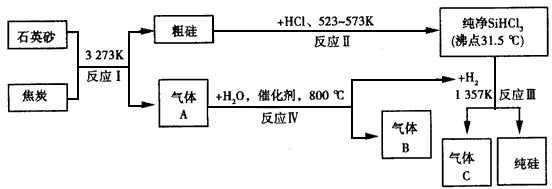
请回答下列问题(各元素用相应的元素符号表示)。
(1)在上述生产过程中,属于置换反应的有__(填反应的代号“I~Ⅳ”)。
(2)A、B、C三种气体在上述生产过程中可循环利用的是___;在“节能减排”中作为减排目标的一种气体是___。
(3)化合物甲的用途很广,有些已应用于高、精、尖科技领域。通常可作建筑工业和造纸工业上的黏合剂。将石英砂和纯碱按一定比例混合加热至1373~1 623 K反应生成化合物甲,其化学方程式为___。
(4)利用反应Ⅲ能制得纯硅的原因是___。
(5)已知反应Ⅳ中产物的总能量比反应物的总能量低,则在密闭容器内反应Ⅳ达到平衡,改变下列 条件,气体B的物质的量增大的是___。
a.缩小容器的容积
b.降低反应体系的温度
c.加入少量NaOH固体(生成物在此温度下不分解)
d.加入少量催化性能更好的催化剂
(6)金属镍(Ni)与气体A能形成常温下为液态的Ni(A)4、利用Ni(A)4的生成与分解可以制得纯度很高的纳米镍,写出Ni( A)4在423K时分解的化学方程式___。