时间:2025-06-26 03:05:08
1、选择题 下列各转化关系中,加入氧化剂能实现的是(? )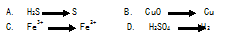
2、选择题 已知下列氧化剂均能氧化+4价的硫元素,为除去稀硫酸中混有的亚硫酸,以得到纯净的稀硫酸,应选用的最合理的氧化剂是(?)
A.KMnO4
B.Ca(ClO)2
C.H2O2
D.Cl2
3、选择题 在3S + 6KOH = 2K2S + K2SO3 + 3H2O 反应中,做氧化剂的S原子与做还原剂的S原子的物质的量之比是( )
A.1:2
B.2:1
C.1:3
D.3:1
4、选择题 下列表示物质结构的化学用语或模型正确的是
A.二氧化碳的结构式:O=C=O
B.HF的电子式: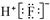
C.Cl-离子的结构示意图: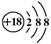
D.CH4分子的球棍模型:
5、选择题 下列说法正确的是( )。
A.高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应
B.CO2和钠在一定条件下反应可以得到金刚石和碳酸钠,反应中氧化剂和还原剂的物质的量之比是3∶4
C.现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl
D.从燃煤烟道灰中(含GeO2)提取半导体材料单质锗(Ge),没有发生氧化还原反应