时间:2025-06-26 02:52:48
1、判断题 (16分)天然气化工是重庆市的支柱产业之一。以天然气为原料经下列反应路线可得工程塑料PBT。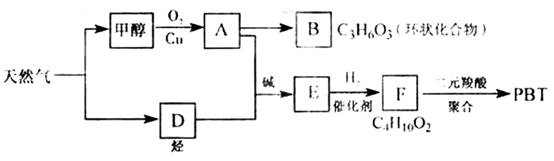
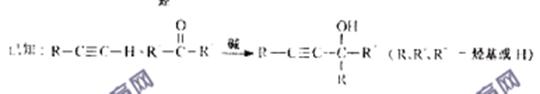
(1)B分子结构中只有一种氢、一种氧、一种碳,则B的结构简式是?;B的同分异构体中与葡萄糖具有类似结构的是?。(写结构简式)
(2)F的结构简式是?;PBT属于?类有机高分子化合物。
(3)由A、D生成E的反应方程式为?,其反应类型为?。
(4)E的同分异构体G不能发生银镜反应,能使溴水褪色,能水解且产物的碳原子数不等,则G在NaOH溶液中发生水解反应的化学方程式是?。
2、选择题 下列不需要用到二氧化硅的是
A.光导纤维
B.计算机芯片
C.石英钟表
D.玛瑙手镯
3、填空题 (13分)
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ?2NH3(g) ?△H=" -92.4" kJ/mol?据此回答以下问题:
?2NH3(g) ?△H=" -92.4" kJ/mol?据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是?(填序号)。
①反应压强为20Mpa~50Mpa?②500℃的高温?③铁触媒作催化剂?④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2?T1(填>、=、<),判断的依据是:?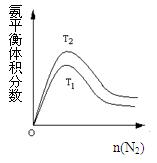
(3)合成氨气所需的氢气可以由水煤气分离得到。涉及反应信息如下:
反应一:C(s)+H2O(g) H
H 2(g)+CO(g) 平衡常数K1
2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g) H2(g)+CO2(g)?平衡常数K2
H2(g)+CO2(g)?平衡常数K2
① K1的表达式:K1=?
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
4、选择题 工业生产中物质制备时,通过下列的反应原理一步完成获得产物,符合“绿色化学”原则的反应原理是( )
A.加成反应
B.分解反应
C.取代反应
D.置换反应
5、选择题 以乙烯为原料生产环氧乙烷的方法很多。经典的方法是氯代乙醇法,它包括两步反应:
① CH2=CH2+Cl2+H2O ClCH2CH2OH+HCl
ClCH2CH2OH+HCl
② ClCH2CH2OH+HCl+Ca(OH)2
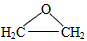 +CaCl2+H2O
+CaCl2+H2O
现代石油化工采用银作催化剂,可以实现一步完成,反应式为: 2CH2=CH2+O2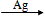
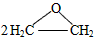
与经典方法相比,现代方法的突出优点是
[? ]
A.所使用的原料没有爆炸的危险
B.符合绿色化学(green chemistry)中的最理想的“原子经剂”(atom economy)
C.对设备的要求较低
D.充分利用了加成反应的原理