时间:2025-06-26 02:51:12
1、填空题 某探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: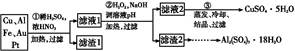
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为 ?。?
(2)第②步加H2O2的作用是 ?;?
调溶液pH的目的是使 生成沉淀。?
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。?
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
上述三种方案中, 方案不可行,原因是 ? ;?
从原子利用率角度考虑, 方案更合理。?
(5)探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++H2Y2- CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ?;?
CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ?;?
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是 ?。?
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
参考答案:(1)Cu+2N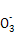 +4H+
+4H+ Cu2++2NO2↑+2H2O或3Cu+2N
Cu2++2NO2↑+2H2O或3Cu+2N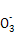 +8H+
+8H+ 3Cu2++2NO↑+4H2O(2分)
3Cu2++2NO↑+4H2O(2分)
(2)将Fe2+氧化为Fe3+(1分) Fe3+、Al3+(2分)
(3)加热脱水(2分)
(4)甲(2分) 所得产品中含有较多Fe2(SO4)3杂质(1分) 乙(2分)
(5)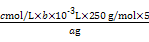 ×100% (2分)? c(2分)
×100% (2分)? c(2分)
本题解析:(1)铜和浓硝酸、稀硫酸的混合酸反应为:
开始发生:Cu+2N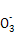 +4H+
+4H+ Cu2++2NO2↑+2H2O,
Cu2++2NO2↑+2H2O,
最后发生:3Cu+2N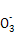 +8H+
+8H+ 3Cu2++2NO↑+4H2O;金属混合物中只有Au和Pt不溶于硝酸,故滤渣的主要成分是Au和Pt;(2)第②步加入H2O2的目的是将Fe2+氧化为Fe3+;H2O2氧化Fe2+时生成的是Fe3+和H2O,不引入杂质,对环境无污染;调整pH,使溶液中的Fe3+、Al3+转化为沉淀;(3)用第③步中所得的五水硫酸铜制取无水硫酸铜的方法是加热脱水;(4)滤渣2的主要成分是氢氧化铁和氢氧化铝,以此为基础分析该探究小组设计的三种方法,其中方案甲中制得的产品中一定含有较多的Fe2(SO4)3杂质;方案乙和丙中,从原子利用的角度考虑,乙方案最合理;(5)根据探究小组的方案,可知计算五水硫酸铜质量分数的表达式为:
3Cu2++2NO↑+4H2O;金属混合物中只有Au和Pt不溶于硝酸,故滤渣的主要成分是Au和Pt;(2)第②步加入H2O2的目的是将Fe2+氧化为Fe3+;H2O2氧化Fe2+时生成的是Fe3+和H2O,不引入杂质,对环境无污染;调整pH,使溶液中的Fe3+、Al3+转化为沉淀;(3)用第③步中所得的五水硫酸铜制取无水硫酸铜的方法是加热脱水;(4)滤渣2的主要成分是氢氧化铁和氢氧化铝,以此为基础分析该探究小组设计的三种方法,其中方案甲中制得的产品中一定含有较多的Fe2(SO4)3杂质;方案乙和丙中,从原子利用的角度考虑,乙方案最合理;(5)根据探究小组的方案,可知计算五水硫酸铜质量分数的表达式为: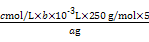 ×100%;滴定过程中,未干燥锥形瓶,对结果无影响,排除a;滴定终点时滴定管尖嘴中产生气泡,造成消耗EDTA的读数偏小,测定结果偏低,排除b;未除净干扰离子,造成EDTA消耗偏多,测定结果偏高,选c。
×100%;滴定过程中,未干燥锥形瓶,对结果无影响,排除a;滴定终点时滴定管尖嘴中产生气泡,造成消耗EDTA的读数偏小,测定结果偏低,排除b;未除净干扰离子,造成EDTA消耗偏多,测定结果偏高,选c。
本题难度:一般
2、选择题 镁条在空气中燃烧后,其生成物中可能含有的物质是( ? )
A.MgCO3、MgO、Mg3N2
B.Mg(OH)2、MgO、MgCO3
C.MgO、Mg3N2、C
D.Mg2N3、C、MgO
参考答案:C
本题解析:
本题难度:一般
3、填空题 (10分)某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: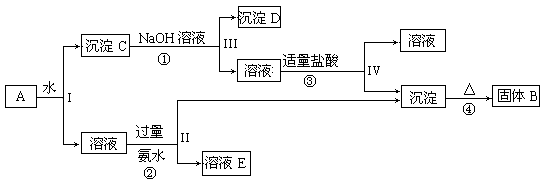
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是?。
(2)写出①、②、③离子方程式④化学反应方程式
①?;②?;
③?;④?。
参考答案:(1)过滤
(2)①Al2O3+2OH-=2AlO2-+H2O
②Al3++3NH3·H2O=Al(OH) 3↓+3NH4+
③AlO2-+H++H2O=Al(OH) 3↓
④2Al(OH) 3 Al2O3+3H2O
Al2O3+3H2O
本题解析:考查物质分离、铝的化合物物性质
Al2O3和Fe2O3不溶于水,过滤后得到沉淀C(Al2O3和Fe2O3)与滤液(KAl(SO4)2),在滤液中加入过量氨水:Al3++3NH3·H2O=Al(OH) 3↓+3NH4+
沉淀C中的Al2O3可溶于强碱:Al2O3+2OH-=2AlO2-+H2O,沉淀D的主要成份为Fe2O3,过滤得到滤液的主要成分为NaAlO2,加入适量盐酸:AlO2-+H++H2O=Al(OH) 3↓
Al(OH) 3加热脱水可得到Al2O3:2Al(OH) 3 Al2O3+3H2O
Al2O3+3H2O
本题难度:一般
4、填空题 某同学欲检验抗酸药中是否含有Al(OH)3,操作如下:取药剂3-4片研碎,向样品中加入过量的盐酸,过滤,得澄清溶液,向澄清溶液中滴加NaOH溶液,观察到有白色沉淀,继续加过量NaOH溶液,白色沉淀又溶解。你能得出该抗酸药中是否含有Al(OH)3____(填“含”或“不含”),请写出有关反应的化学方程式:①Al(OH)3+3HCl=AlCl3+3H2O;②________________;③________________。
参考答案:含;②AlCl3+3NaOH=Al(OH)3↓+3NaCl;③Al(OH)3+NaOH=NaAlO2+2H2O
本题解析:
本题难度:一般
5、选择题 下列物质中,既能与盐酸又能与NaOH溶液反应的是
A.氢氧化铝
B.硅酸钠
C.碳酸钠
D.二氧化硅
参考答案:A
本题解析:分析:根据物质间的反应进行判断,中学常见的既能与酸反应又能与碱反应的物质主要有:
①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;
②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;
③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO3、CH3COONH4等;
④某些具有两性的金属:Zn、Al等;
⑤某些非金属:Si、S等;
⑥其它一些物质.如:a、某些盐类物质既与酸反应,又与碱反应;
b、个别酸性氧化物SiO2;
c、具有还原性的无氧酸:H2S、HI等与氧化性酸反应、与碱反应;
d、具有氧化性酸:浓H2SO4、HNO3等与还原性酸反应、与碱反应,以此解答本题.
解答:A.氢氧化铝是两性氢氧化物,能与盐酸反应生成氯化铝与水,与氢氧化钠反应生成偏铝酸钠与水,故A符合;
B.硅酸钠与盐酸反应生成硅酸与氯化钠,不能与氢氧化钠反应,故B不符合;
C.碳酸钠与盐酸反应生成氯化钠、二氧化碳与水,不能与氢氧化钠反应,故C不符合;
D.二氧化硅与氢氧化钠反应生成硅酸钠与水,不能与盐酸反应,故D不符合;
故选A.
点评:本题考查了物质的性质,难度不大,旨在考查学生对知识的理解识记与知识归纳,明确物质的性质是解本题的关键,注意基础知识的积累.
本题难度:简单