时间:2025-06-26 02:48:46
1、选择题 将2 molNaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后,对所得固体进行测定,发现Na2O2无剩余,则所得固体的物质的量(n)为
[? ]
A.
B.
C.
D.
2、选择题  铜投入一定量的浓HNO3中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下
铜投入一定量的浓HNO3中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下 气体。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2恰好使气体完全溶于水中,则通入的O2体积是
气体。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2恰好使气体完全溶于水中,则通入的O2体积是
[? ]
A.
B.
C.
D.
3、选择题 将0. 01mol相同颗粒大小的镁粉、铁粉分别加入到盛有50mL 1mol/L硫酸的两烧杯甲和乙中,下图能正确反映实验结果的是
[? ]
A. 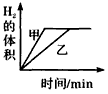
B. 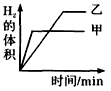
C. 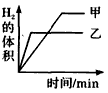
D. 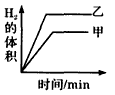
4、选择题 将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到aL混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为
[? ]
A.2:1:1
B.1:1:2
C.1:2:1
D.4:3:3
5、选择题 将2.4mol某金属投入1.8L 2mol/L的某酸溶液中,恰好完全反应,并产生7.2g氢气,则该金属和酸分别是
[? ]
A.二价金属,二元酸
B.二价金属,三元酸
C.三价金属,二元酸
D.一价金属,一元酸