时间:2025-06-26 02:46:18
1、选择题 光导纤维被认为是20世纪最伟大的发明之一。光导纤维的主要成分是?
A.Si
B.SiO2
C.Na2SiO3
D.SiCl4
参考答案:B
本题解析:Si常用作半导体材料,A错误;Na2SiO3常用作粘合剂,C错误;SiCl4是粗硅提纯过程的中间产物。而SiO2常用作光导纤维,答案选B。
本题难度:简单
2、选择题 硅及其化合物在材料领域中应用广泛。下列叙述中不正确的是(?)
A.硅单质可用来制造太阳能电池
B.装碱性溶液的玻璃试剂瓶不能用玻璃塞
C.二氧化硅是制造光导纤维的材料
D.二氧化硅属于酸性氧化物,不能与任何酸反应
参考答案:D
本题解析:A.太阳能电池的原料是硅单质,故A正确; B.制造玻璃的主要原料有SiO2、Na2CO3、CaCO3,SiO2与碱性溶液反应生成有粘性的物质,瓶塞和瓶口粘连。故B正确;C.光导纤维的材料是二氧化硅,故C正确;D.SiO2不溶于水,但能溶于氢氟酸,二氧化硅能和氢氟酸反应生成四氟化硅,故D错误;
故选D.
本题难度:一般
3、选择题 下列说法中,正确的是
A.水晶和陶瓷的主要成分都属于硅酸盐
B.单质硅是制造光导纤维的材料
C.硅酸钠是制备硅胶和木材防火剂的原料
D.工业上用盐酸刻蚀玻璃
参考答案:C
本题解析:A、水晶的主要成分是二氧化硅,错误;B、制造光导纤维的材料的主要材料是二氧化硅;C、正确;D工业上用氢氟酸刻蚀玻璃,错误。
本题难度:简单
4、选择题 常温下,A、B组成的混合气体(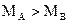 )经分析发现无论怎样混合,气体中仅含的C、O两种元素的质量比总小于3∶8,若混合气体中C、O质量比为1∶8,则A、B两气体的体积比可能为( )
)经分析发现无论怎样混合,气体中仅含的C、O两种元素的质量比总小于3∶8,若混合气体中C、O质量比为1∶8,则A、B两气体的体积比可能为( )
①3∶4 ② 2∶1 ③4∶1 ④4∶3 ⑤1∶2
A.只有⑤
B.①②
C.④⑤
D.②④
参考答案:C
本题解析:由于该混合气体中只含碳、氧两种元素,且碳、氧两种元素质量之比总小于3∶8,根据目前所学知识知其中一定含有CO2,另一种气体只含有氧元素,所以常见的可以是氧气和臭氧,由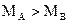 ,所以一种可能是A为CO2,B为O2,此时二者的物质的量之比为1∶2;另一种可能是A为O3,B为CO2,此时二者的物质的量之比为4∶3。
,所以一种可能是A为CO2,B为O2,此时二者的物质的量之比为1∶2;另一种可能是A为O3,B为CO2,此时二者的物质的量之比为4∶3。
本题难度:简单
5、实验题 单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式?。
(2)装置C中的试剂是?;装置F的作用是?;
装置E中的h瓶需要冷却的理由是?。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式:?。
②滴定前是否要滴加指示剂??(填“是”或“否”),请说明理由?。
③滴定前检验Fe3+是否被完全还原的实验操作是?。
参考答案:(1)MnO2+4H++2Cl- ?Mn2++Cl2↑+2H2O(2分)
?Mn2++Cl2↑+2H2O(2分)
(2)浓硫酸(2分);
防止空气中的水进入H中;产物SiCl4沸点低,需要冷凝收集(2分)
(3)①5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O(2分)
②否;KMnO4溶液的紫红色可指示反应终点;(2分)
③取少量还原后的溶液于试管中,滴加KSCN溶液,若不出现血红色,表明Fe3+已完全还原(2分)
本题解析:(1)装置A为制取氯气的装置,所以发生的离子反应方程式为MnO2+4H++2Cl- ?Mn2++Cl2↑+2H2O;
?Mn2++Cl2↑+2H2O;
(2)装置B为除去氯气中的氯化氢,所以装置C中的试剂是浓硫酸,干燥氯气;四氯化硅遇水易水解,所以装置F的作用是防止空气中的水进入H中;产物SiCl4沸点低,需要冷凝收集,所以h瓶需要冷却;
(3)①亚铁离子与酸性高锰酸钾反应被氧化成铁离子,高锰酸钾被还原成锰离子,离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
②滴定前不用加任何指示剂,因为高锰酸钾溶液本身为紫红色溶液,可用高锰酸钾溶液的颜色判断反应终点;
③Fe3+的检验通常用KSCN溶液,取少量还原后的溶液于试管中,滴加KSCN溶液,若不出现血红色,表明Fe3+已完全还原。
本题难度:一般