时间:2025-06-26 02:43:47
1、选择题 有关乙烯分子中的化学键描述正确的是(?)
A.每个碳原子的sp2杂化轨道中的其中一个形成π键
B.每个碳原子的未参加杂化的2p轨道形成σ键
C.碳原子的三个sp2杂化轨道与其它原子形成三个σ键
D.碳原子的未参加杂化的2p轨道与其它原子形成σ键
参考答案:C
本题解析:乙烯分子中含有碳碳双键,属于平面型结构,其中碳原子是sp2杂化。由于杂化轨道电子只能形成σ键,未参与杂化的参与形成π键,所以正确的答案选C。
点评:该题是高考中的常见考点,属于基础性试题的考查。该题的关键是明确杂化轨道类型与σ键和π键形成的关系,然后结合题意灵活运用即可。
本题难度:一般
2、选择题 科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:?
NaHCO3+H2  ?HCOONa+H2O下列有关说法正确的是
?HCOONa+H2O下列有关说法正确的是
A.储氢、释氢过程均无能量变化
B.储氢过程中,NaHCO3被氧化
C.NaHCO3含有离子键和共价键
D.释氢过程中,每消耗0.1molH2O放出2.24L的H2
参考答案:C
本题解析:A、储氢、释氢过程均存在能量变化;B、储氢过程中,NaHCO3被H2还原;C、NaHCO3中Na+与HCO3-之间存在离子键,HCO3-中存在共价键;D、释氢过程中,每消耗0.1molH2O放出0.1molH2,但没说明状态,无法知道其体积。
本题难度:一般
3、选择题 CH4催化还原NOx可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH=-574 kJ/mol
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g); ΔH=-1160 kJ/mol
下列说法不正确的是 ( )
A.反应①②均为放热反应
B.反应①②转移的电子数相同
C.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH=-a kJ/mol,a<574
D.若用标准状况下4.48 L CH4通过上述反应还原NO2至N2,放出的热量为173.4 kJ
参考答案:C
本题解析:A正确,ΔH<0为放热反应;B正确,C元素的化合价都由—4价升高到+4价;
C错,气态水变成液态水要放出热量,所以,a>574;C正确;由热化学反应方程式可得标准状况下4.48 L CH4通过上述反应还原NO2至N2,放出的热量为173.4 kJ
本题难度:困难
4、选择题 关于化学键的下列叙述中正确的是( )
A.化学键存在于相邻原子之间,是一种强相互引力作用
B.化学键可存在于不同种元素的原子之间,也可存在于同种元素的原子之间
C.化学键中原子间强烈作用的实质是万有引力作用
D.单质中一定存在化学键作用
参考答案:A、化学键通常指的是相邻的两个或多个原子之间的强烈的相互作用,这种相互作用既包括吸引力也包括排斥力,故A错误;
B、化学键通常指的是相邻的两个或多个原子之间的强烈的相互作用,可存在于不同种元素的原子之间,也可存在于同种元素的原子之间,故B正确;
C、万有引力研究的是宏观物质不是微观粒子,故C错误;
D、单质中不一定含有化学键,如稀有气体是单原子分子,稀有气体中不存在化学键只存在分子间作用力,故D错误;
故选B.
本题解析:
本题难度:简单
5、填空题 在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Al+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为?,含有离子键、?等化学键。
(2)生成物中含有10个电子的分子是?(写分子式),该分子的空间构型为?,中心原子的杂化方式为?。
(3)反应物中电负性最大的元素为?(填元素符号),写出其原子最外层的电子排布图:?。
(4)Al单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。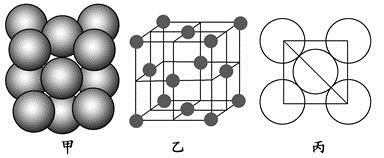
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为?;Al晶体的密度为?(用字母表示)。
参考答案:(1)Na3AlF6 配位键
(2)H2O V形 sp3
(3)F 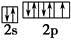
(4)4 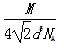
本题解析:(1)冰晶石的化学式为Na3AlF6,Na+与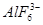 之间为离子键,而
之间为离子键,而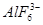 是以配位键形成的。(2)生成物中10电子分子是H2O,氧原子采取sp3杂化,由于氧原子含有两对孤电子对,故分子结构为V形。(3)F是电负性最大的元素,其最外层电子排布图为
是以配位键形成的。(2)生成物中10电子分子是H2O,氧原子采取sp3杂化,由于氧原子含有两对孤电子对,故分子结构为V形。(3)F是电负性最大的元素,其最外层电子排布图为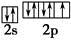 。(4)铝晶胞的原子处于晶胞顶角和面心,故一个晶胞含有的Al原子数目为6×
。(4)铝晶胞的原子处于晶胞顶角和面心,故一个晶胞含有的Al原子数目为6×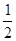 +8×
+8×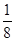 =4。设Al晶胞的边长为a,则有:2a2=(4d)2,a=2d,Al晶胞的体积为V=16d3,故Al晶体的密度为
=4。设Al晶胞的边长为a,则有:2a2=(4d)2,a=2d,Al晶胞的体积为V=16d3,故Al晶体的密度为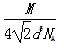 。
。
本题难度:一般