时间:2025-06-26 02:43:05
1、填空题 在某一容积为2 L的密闭容器内,加入0.8 mol的H2和0.6 mol的I2,在一定的条件下发生如下反应:
H2(g)+I2(g)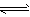 2HI(g)+Q(Q>0)
2HI(g)+Q(Q>0)
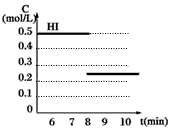
反应中各物质的浓度随时间变化情况如图1: 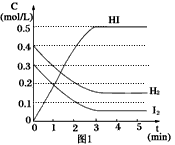
(1)该反应的化学平衡常数表达式为____________。
(2)根据图1数据,反应开始至达到平衡时,平衡速率v(HI)为____________。
(3)反应达到平衡后,第8分钟时: ①若升高温度,化学平衡常数K____________(填写增大、减小或不变) HI浓度的变化正确的是____________(用图2中a-c的编号回答) 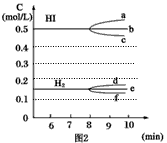
②若加入I2,H2浓度的变化正确的是____________。(用图2中d-f的编号回答)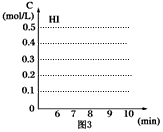
(4)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。
参考答案:
(1)K=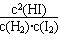
(2)0.167 mol/L·min
(3)①减小;c②f
(4)如下图:
本题解析:
本题难度:一般
2、选择题 在一定温度下,下列叙述不是可逆反应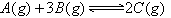 达到平衡的标志的是
达到平衡的标志的是
[? ]
(1)C的生成速率与C的分解速率相等;
(2)单位时间生成amol A,同时生成3amol B;
(3)A、B、C的浓度不再变化;
(4)A、B、C的压强不再变化;
(5)混合气体的总压强不再变化;
(6)混合气体的物质的量不再变化;
(7)单位时间消耗amol A,同时生成3amol B;
(8)A、B、C的分子数目比为1:3:2。
A.(2)(8)
B.(7)(4)
C.(1)(3)
D.(5)(6)
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列关于实验的描述错误的一项是 ( )
A.取5mL 0.1 mol/L KI溶液,滴加0.1mol/LFeCl3溶液5~6滴,继续加入2 mLCCl4,充分振荡,取上层溶液,滴加KSCN溶液,溶液呈现血红色,证明溶液中还存在Fe3+
B.在铁钉的析氢腐蚀实验中,在负极周围加入K3[Fe(CN)6]溶液会出现蓝色沉淀
C.燃料电池实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果要好得多
D.蔗糖的“黑面包”实验中只体现了浓硫酸的脱水性
参考答案:D
本题解析:蔗糖的黑面包实验中,表现了浓硫酸的脱水性和强氧化性,因此答案D是错误的。
考点:考查了浓硫酸强氧化性,脱水性的相关知识点
本题难度:一般
4、选择题 一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是?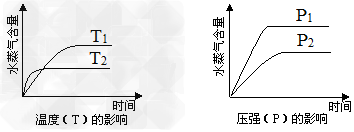
[? ]
A.CO2(g)?+?H2(g) CO(g)?+?H2O(g)?ΔH>0
CO(g)?+?H2O(g)?ΔH>0
B.CH3CH2OH(g) CH2=CH2(g)?+?H2O(g)?ΔH>0
CH2=CH2(g)?+?H2O(g)?ΔH>0
C.2C6H5CH2CH3(g)?+?O2(g) 2C6H5CH=CH2(g)?+?2H2O(g)?ΔH<0
2C6H5CH=CH2(g)?+?2H2O(g)?ΔH<0
D.CO2(g)?+?2NH3(g) CO(NH2)2(s)?+?H2O(g)?ΔH<0
CO(NH2)2(s)?+?H2O(g)?ΔH<0
参考答案:D
本题解析:
本题难度:一般
5、选择题 有某可逆反应aA(g)+bB(g) cC(g) △H=Q?kJ/mol;下图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是
cC(g) △H=Q?kJ/mol;下图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是 
[? ]
A.a+b<c时,y轴表示平衡混合气中C的质量分数
B.a+b<c时,y轴表示平衡混合气的平均摩尔质量
C.△H>0时,y轴表示达到平衡时B的转化率
D.△H<0时,y轴表示达到平衡时A的转化率
参考答案:BD
本题解析:
本题难度:一般