时间:2025-06-26 02:34:54
1、选择题 根据海水综合利用的工业流程图(如图),判断下列说法正确的是(? )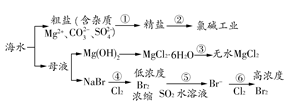
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.在过程④、⑥反应中每氧化0.2 mol Br-,需消耗2.24 L Cl2
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
参考答案:D
本题解析:过程①是粗盐的精制,其中除去可溶性杂质离子的过程为化学过程,A错;过程③中若将MgCl2·6H2O灼烧,得到MgO,B错;过程④、⑥反应中每氧化0.2 mol Br-,需消耗标准状况下2.24 L Cl2,题中未指明气体的状态,C错;过程⑤的反应为SO2+Br2+2H2O=H2SO4+2HBr,溶液显强酸性,D对。
本题难度:一般
2、选择题 下列物质不属于硅酸盐的是( )
A.粘土
B.硅藻土
C.Al2(Si2O5)(OH)4
D.Mg2SiO4
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列反应原理不符合工业冶炼金属实际情况的是?(?)
A.2HgO2Hg+O2↑
B.2NaCl(熔融) 2Na+Cl2↑
2Na+Cl2↑
C.2MgO(熔融) 2Mg+O2↑
2Mg+O2↑
D.Fe2O3+3CO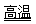 2Fe+3CO2
2Fe+3CO2
参考答案:C
本题解析:MgO冶炼金属Mg采用与焦炭反应,而氯化镁冶炼金属镁则用电解法制取;
本题难度:简单
4、选择题 下列有关铁、铝的冶炼的说法中,正确的是? ( )
A.冶金工业中,金属铁的冶炼主要采用电解法
B.炼铁过程中铁的氧化物被焦炭还原生成单质铁,电解冶炼铝的过程中,阳极生成铝单质,阴极生成氧气
C.炼铁的主要原料是铁矿石、焦炭、生石灰和空气,电解冶炼铝的原料是氧化铝和冰晶石
D.铁、铝冶炼设备分别是炼铁高炉和铝电解槽
参考答案:D
本题解析:铁的冶炼采用热还原法。A错误;炼铁过程中CO作为还原剂把铁从其氧化物中还原出来,冶炼铝的过程中,阳极生成O2,阴极生成铝单质,B错误;冶炼铝的原料为Al2O3,冰晶石只是作为助熔剂,C错误;D正确。
本题难度:一般
5、选择题 常温下,能与SiO2发生反应的物质是(?)
A.烧碱
B.氢氟酸
C.水
D.氧化钙
参考答案:AB
本题解析:常温下能与二氧化硅反应的只有烧碱与氢氟酸,氧化钙可在高温下与二氧化硅反应,水在高温下也不与二氧化硅反应。
本题难度:简单