时间:2025-06-26 02:29:11
1、选择题 下列说法中正确是
[? ]
A.周期表是按原子量逐渐增大的顺序从左到右排列的
B.最外层电子数相同的元素都是同一族
C.同族元素原子的最外层电子数一定相同
D.同周期元素原子的电子层数相同
2、选择题 1898年,居里夫人发现了放射性元素镭(Ra),因而获得诺贝尔化学奖,已知镭是周期表第7周期IIA族的元素,下列关于镭说法不正确的是( )
A.在化合物中呈现正二价
B.单质能与水剧烈反应放出氢气
C.碳酸盐难溶于水
D.氢氧化物呈两性
3、填空题 已知A、B、C、D、E是短周期中的五种非金属元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色固体,易溶于二硫化碳。
(1) 请写出元素符号: B___________ D___________
(2) 画出E的阴离子的结构示意图 ______________________
(3) A的单质和C的单质在一定条件下反应生成化合物X,用电子式表示化合物X的形成过程:____________________________。向X的水溶液中滴入酚酞溶液,会观察到什么现象:______________
4、选择题 下列关于地壳中含量最多的金属元素与地壳中含量最多的非金属元素的说法中,不正确的是
[? ]
A.题中所指的元素分别是Al和O
B.题中所指的元素分别是Fe和O
C.这两种元素组成的化合物的相对分子质量是102
D.这两种元素组成的化合物能与酸反应
5、推断题 核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q,其中:在同周期元素中,Z的金属性最强,Q的非金属性最强;W的单质是自然界存在的黄色固体;X、Y、W在周期表中的相对位置关系如图所示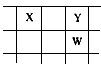
(1)五种元素形成的单质中常用作强氧化剂的是________、________(填化学式)
(2)这五种元素中,原子半径最大的是________(填化学式);由Z、W、Q形成的简单离子半径由大到小的顺序是________(用化学式表示);X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序为________(用化学式表示)。
(3)Y和Z形成的一种化合物中含有离子键和共价键,写出该化合物与水反应的化学方程式________________________。
(4)Z与Q反应生成的化合物属于________化合物;电解该化合物的饱和溶液,阳极的电极反应式为________________;电解一段时间后,将阳极产物和阴极溶液混合,反应的化学方程式是________________。
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9 g该化合物燃烧生成XY2和液态H2Y时。放出
140 kJ的热量。写出该化合物燃烧热的热化学方程式:________________________。