时间:2025-06-26 02:25:17
1、填空题 “富煤、贫油、少气”是我国能源发展面临的现状。随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义。下图是煤化工产业链之一。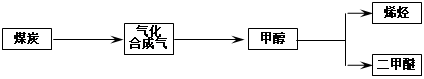
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出热值很高的煤炭合成气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol
参考答案:
本题解析:
本题难度:困难
2、填空题 (10分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中C02的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)下列关于C02的用途不正确的是?(填序号)。
A.二氧化碳能溶于水,可用于生产碳酸型饮料
B.固体二氧化碳俗称干冰,可用于人工降雨
C.二氧化碳用于灭火是因为降低了可燃物的着火点
D.超临界二氧化碳作萃取溶剂用于从天然产物提取和净化活性组分
E.二氧化碳可以作为气肥,提高农作物的产量
(2)目前工业上有一种方法是用C02来生产甲醇。为探究其反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)? ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)? ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率:v(H。)=??。
②该反应的平衡常数为?。
(3)以KHC03溶液为电解质,用电解的方法也可以将CO2还原为甲醇。请写出电解时阴极的离子方程式:?
(4)金刚石、石墨烯、线型碳是碳的几种同素异形体。从键的类型分析它们的稳定性由强到弱的顺序为?
参考答案:(10分)
(1)C?(2分)
(2)①0.225mol?L-1?min-1(2分)。② 5.33( mol?L-1)-2 (单位不作要求,2分)
(3)CO2+6HCO3-+6e-=CH3OH+6CO32-+H2O(或CO2+5H2O+6e-=CH3OH+6OH -)(2分)
(4)线型碳>石墨烯>金刚石(2分)
本题解析:(1)燃烧的必要条件是可燃物达到着火点且有氧气,二氧化碳用于灭火主要是采用将可燃物与氧气隔离的办法达到目的
(2)①v(CO2)=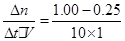 =0.075mol?L-1?min-1,由方程式的系数比可知v(H2)=3v(CO2)=0.225mol?L-1?min-1
=0.075mol?L-1?min-1,由方程式的系数比可知v(H2)=3v(CO2)=0.225mol?L-1?min-1
②依据所给数据,平衡常数K=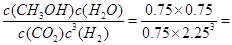 5.33( mol?L-1)-2
5.33( mol?L-1)-2
(3)由化合价的升降可知,CO2中的碳元素与+4价降到CH3OH中碳元素的—2价,得电子,发生了还原反应,故:CO2+6e- CH3OH,溶液为碱性环境,为达到电荷守恒,则CO2+6e-
CH3OH,溶液为碱性环境,为达到电荷守恒,则CO2+6e- CH3OH+6OH -,再根据原子守恒得:CO2+5H2O+6e-=CH3OH+6OH -)
CH3OH+6OH -,再根据原子守恒得:CO2+5H2O+6e-=CH3OH+6OH -)
(4)物质内的键的键能越大,则物质越稳定,由于键能顺序为:碳碳叁键>碳碳双键>碳碳单键,故稳定性由强到弱的顺序为:线型碳>石墨烯>金刚石
本题难度:简单
3、填空题 Ⅰ.如图所示,在大试管里放入一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,把这个装置这样放置约一周后,观察到铁丝发生的变化是______________________,原因是____________________.试管里的水面会上升,最终上升高度约为_______,原因是_________________________________________________________________________________________________________________.
Ⅱ.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
(1)A中反应的离子方程式为__________________________________________.
(2)B中Sn电极的电极反应式为________________________________________,Sn电极附近溶液的pH__________(填“增大”、“减小”或“不变”).
(3)C中被腐蚀的金属是________,总反应式为________________________.比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是______________________.
参考答案:Ⅰ.铁丝表面生成一层红棕色的铁锈 铁发生吸氧腐蚀 空气中氧气的体积分数约为1/5,经过足够长的时间后,氧气与铁反应完
空气中氧气的体积分数约为1/5,经过足够长的时间后,氧气与铁反应完
Ⅱ.(1)Fe+2H+===Fe2++H2↑
(2)2H++2e-===H2↑ 增大
(3)Zn Zn+2H+===Zn2++H2↑ B>A>C
本题解析:该装置中铁丝发生吸氧腐蚀生成铁锈(Fe2O3·nH2O),经过足够长的时间后,试管内空气中的氧气完全被吸收,导致压强减小,液面上升,上升高度与空气中所含氧气的体积分数相同,约占 .
.
(Ⅱ)A中Fe失电子,氢离子得到电子被还原为氢气;B中形成原电池,Sn为正极,为电子流入的一极,氢离子得电子被还原产生氢气,由于消耗了溶液中的氢离子,所以pH增大;C中锌作负极被氧化,Zn-2e-===Zn2+,正极:2H++2e-===H2↑,总反应为Zn+2H+===Zn2++H2↑,C中Fe被保护,B中能加快腐蚀.
点评:本题考查铁的腐蚀相关的电化学知识,难度不大,侧重考查学生实验观察能力及分析问题能力,解题的关键是要读懂图,了解问题的实质。
本题难度:一般
4、填空题 (10分)氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。常用电离常数Kb和电离度α来定量表示氨水的电离程度,它们均可通过各浓度氨水对应的c(OH-)进行换算。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1氨水
【实验数据】(不必填表格)
| 烧杯号 | V氨水 (mL) | V水(mL) | c (NH3·H2O) (mol·L-1) | c(OH-) | Kb | α |
| 1 | 50.00 | 0.00 | | 1.34×10-3 | | |
| 2 | 25.00 | 25.00 | | 9.48×10-4 | | |
| 3 | 5.00 | 45.00 | | 4.24×10-4 | | |
 。
。
参考答案:(1)1.8×10-3 (2)B c(NH4+)>c(Cl-)>c(.OH-)>c(H+)
(3)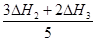 (4)2NH3+6OH-—6e-=N2+6H2O
(4)2NH3+6OH-—6e-=N2+6H2O
本题解析:
试题分析;(1)一水合氨的电离方程式为NH3?H2O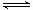 NH4++OH-,则根据第一组实验中的数据可知氨水的电离平衡常数Kb=
NH4++OH-,则根据第一组实验中的数据可知氨水的电离平衡常数Kb= =
=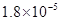 。
。
(2)0.1mol/L氨水溶液的pH小于13,则B曲线表示氨水的滴定曲线。A点氨水过量溶液显碱性,且盐酸溶液的体积大于10ml,则曲线a点所对应的溶液中各离子浓度由大到小的排列顺序为c(NH4+)>c(Cl-)>c(.OH-)>c(H+)。
(3)根据盖斯定律可知(②×3+③×2)÷5即得到反应①,因此△H1=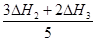 。
。
(4)原电池中负极失去电子发生氧化反应,则根据总反应式4NH3+3O2=2N2+6H2O以及正极上的电极反应式为O2+2H2O+4e—=4OH—可知负极上的电极反应式为2NH3+6OH-—6e-=N2+6H2O。
考点:考查电离常数、离子浓度大小比较、盖斯定律以及电化学原理的天天等
本题难度:困难
5、选择题 一种碳纳米管能够吸附氢气,可做二次电池(如下图所示)的碳电极。该电池的电解质为6 mol·L-1 KOH溶液,下列说法中正确的是?
A.充电时阴极发生氧化反应
B.充电时将碳电极与电源的正极相连
C.放电时碳电极反应为H2-2e-=2H+
D.放电时镍电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
参考答案:D
本题解析:A项,充电时,阴极发生还原反应,错误;B项,碳电极为负极,应与外接电源的负极相连,作阴极,错误;C项,放电时,碳电极(负极)反应为H2-2e-+2OH-=2H2O,错误;正极反应为2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-,D正确。
本题难度:一般