时间:2025-06-26 02:22:01
1、选择题 上海染色馒头事件曾一度引起人们的恐慌,该公司在馒头中添加了一种叫做柠檬黄 的物质,食用染色馒头会出现一些过敏反应,柠檬黄的化学式为C16H9N4O9S2Na3,下列相关叙述正确的是(?)
的物质,食用染色馒头会出现一些过敏反应,柠檬黄的化学式为C16H9N4O9S2Na3,下列相关叙述正确的是(?)
A.柠檬黄是由七种元素组成的
B.柠檬黄是混合物
C.柠檬黄的相对分子质量为534
D.氢氧元素质量比为1∶1
2、选择题 下列化学用语表述正确的是
A.S2-的结构示意图: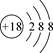
B.氮原子的轨道表示式: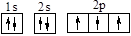
C.CO2的比例模型:
D.氨气分子的结构式: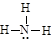
3、选择题 在反应X+2Y= =R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6?g X和Y完全反应后,生成4.4?g R。则在此反应中Y和M的质量之比为( )
=R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6?g X和Y完全反应后,生成4.4?g R。则在此反应中Y和M的质量之比为( )
A.16∶9
B.23∶9
C.32∶9
D.46∶9
4、选择题 知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应:
2S2Cl2+2H2O=4HCl+SO2↑+3S↓。对该反应的说法正确的是?
A.S2Cl2既作氧化剂又作还原剂
B.H2O作还原剂
C.每生成1mol SO2转移4mol电子
D.氧化产物与还原产物物质的量比为3:1
5、选择题 下列化学用语正确的是
A.硝基苯的结构简式:
B.Be原子的核外电子排布式:1s22s22p1
C.氯化铵的电子式:
D.CO2分子的结构式:O=C=O