时间:2025-06-26 02:20:23
1、选择题 设计实验证明亚硫酸既有氧化性又有还原性,必选试剂是 (? )
A.盐酸、浓硫酸、氯化钡溶液
B.溴水、硫化钠溶液、稀硫酸
C.硝酸、硫化氢、氢氧化钠溶液
D.氧气、氯化钡溶液、水
参考答案:B
本题解析:略
本题难度:简单
2、选择题 下列实验一定能证明有SO2存在的是?(?)
①能使澄清石灰水变浑浊? ②能使蓝色石蕊试纸变红色? ③能使品红溶液褪色? ④通入溴水能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀生成? ⑤先通入足量的NaOH溶液,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸
A.都能证明
B.都不能证明
C.③④⑤
D.④
参考答案:D
本题解析:略
本题难度:简单
3、选择题 有下列两种转化途径,某些反应条件和产物已省略,下列有关说法不正确的是
途径① S H2SO4
H2SO4
途径② S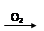 SO2
SO2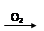 SO3
SO3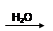 H2SO4
H2SO4
A.途径①反应中体现了浓HNO3的强氧化性和酸性
B.途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本
C.由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e-
D.途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高
参考答案:A
本题解析:途径①反应中只体现了浓HNO3的强氧化性,没有酸性,所以A错误,其余选项均正确。答案选A。
点评:本题非常简单基础。
本题难度:一般
4、填空题
2SO2(g)+O2(g) ≒?2?SO3(g);ΔH=-196.6KJ/mol
(1)该反应在__________(设备)中进行,这种生产硫酸的方法叫做________。
(2)在实际生产中,操作温度选定400∽500℃,这是因为______________。
(3)硫酸工业选定压强通常采用_____________,作出这种选择的依据是______________________________。
参考答案:(1)接触室;接触法。(2)温度较低时,反应速率较小;温度过高,二氧化硫的转化率会降低。考虑到催化剂在400~500℃时,活性最大,所以操作温度选定在400~500℃。(3)常压;在常压下及400~500℃时,二氧化硫的转化率已经很高,若加压会增加设备、投资和能量消耗。
本题解析:(1)接触室;接触法。(2)温度较低时,反应速率较小;温度过高,二氧化硫的转化率会降低。考虑到催化剂在400~500℃时,活性最大,所以操作温度选定在400~500℃。(3)常压;在常压下及400~500℃时,二氧化硫的转化率已经很高,若加压会增加设备、投资和能量消耗。
本题主要考查应用化学反应速率和化学平衡原理解决实际工业生产问题的能力。
本题难度:简单
5、计算题 将SO2和O2以体积比为1:3混合后,通入接触室发生反应2SO2(g)+O2(g) 2SO3(g),达平衡时,在同温、同压下测得反应前与反应后混合气体的密度之比为71:80。求SO2的转化率?并回答SO2接触氧化为SO3时不采取加压措施的原因。
2SO3(g),达平衡时,在同温、同压下测得反应前与反应后混合气体的密度之比为71:80。求SO2的转化率?并回答SO2接触氧化为SO3时不采取加压措施的原因。
参考答案:90%?在工业上不加压,SO2的转化率就达90% 以上,已经很高,若再加压SO2的转化率提高不大,但对设备的要求要提高许多,故没有必要再加压。
本题解析:这是一道关于化学平衡和转化率的综合计算题。根据相同条件下气体的密度之比等于同体积气体的质量之比,且反应前后质量守恒,可得出气体的密度之比等于气体体积的反比。设反应前混合气体中SO2的体积为1 L,O2应为3 L达平衡时SO2的转化的体积为x 。
2SO2(g)+O2(g) ≒?2?SO3(g)?总体积
V/L(起始)? 1? 3? 0? 4L
V/L(转化)? 2x? x?2x
V/ L(平衡)1-2x? 3-x? 2x? 4-x
根据气体的密度之比等于气体体积的反比,可得:
71:80=(4-x):4? x=0.45L,则转化的二氧化硫为0.9L,
二氧化硫的转化率为:0.9L÷1L×100%=90%
在工业上不加压,SO2的转化率就达90% 以上,已经很高,若再加压SO2的转化率提高不大,但对设备的要求要提高许多,故没有必要再加压。
本题难度:一般