时间:2025-06-26 02:18:44
1、填空题 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示__________?,
K值的大小与温度的关系是:温度升高,K值__________?(填“一定增大”、“一定减小”或“可能增大也可能减小”)。
(2)高炉炼铁中发生的基本反应之一为:CO(g) + FeO(s)? ?CO2 (g)+ Fe(s)△H﹥0,其平衡常数可表示为K=c(CO2)/c(CO),已知1100℃时,K=0.263。
?CO2 (g)+ Fe(s)△H﹥0,其平衡常数可表示为K=c(CO2)/c(CO),已知1100℃时,K=0.263。
①升高温度,平衡移动达到新的平衡时,高炉内CO 和CO的体积比____________ (选填“增大”、“减小”或“不变”),平衡常数K值_____________(选填“增大”、“减小”或“不变”);
和CO的体积比____________ (选填“增大”、“减小”或“不变”),平衡常数K值_____________(选填“增大”、“减小”或“不变”);
②1100℃时测得高炉中c(CO )="0.025"
)="0.025"  ,
, ,此时,反应是否处于化学平衡状态__________ (选填“是”或“否”),化学反应速度
,此时,反应是否处于化学平衡状态__________ (选填“是”或“否”),化学反应速度 (正)__________
(正)__________ (逆)(选填“>”、“<”或“:”),其原因是________________。
(逆)(选填“>”、“<”或“:”),其原因是________________。
参考答案:(1)反应进行的越完全?可能增大也可能减小
(2)增大,增大
②否, (正) >
(正) > (逆),其原因是K>0.25
(逆),其原因是K>0.25
本题解析:(1)化学平衡常数K值越大,表示反应进行的越完全;对于有些反应来说,温度高,K大,对于另外的一些反应来说,温度高,K小,所以温度升高,K值可能增大也可能减小;(2) ①中,可以看出反应:CO(g) + FeO(s)? ?CO2 (g)+ Fe(s)△H﹥0,为吸热反应,升高温度,平衡右移,所以CO
?CO2 (g)+ Fe(s)△H﹥0,为吸热反应,升高温度,平衡右移,所以CO 和CO的体积比增大,平衡常数K值也增大,②中1100℃时,K=0.263,所以K=c(CO2)/c(CO)= 0.025/0.1=0.25<0.263,所以还没有达到化学平衡,化学反应速度
和CO的体积比增大,平衡常数K值也增大,②中1100℃时,K=0.263,所以K=c(CO2)/c(CO)= 0.025/0.1=0.25<0.263,所以还没有达到化学平衡,化学反应速度 (正) >
(正) > (逆),原因是K>0.25。
(逆),原因是K>0.25。
点评:该题考查化学平衡的移动,是高考的考查重点,该题的信息量较大,但是难度不大。
本题难度:一般
2、选择题 已知反应①CO(g)+CuO(s)  CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
A.反应①的平衡常数
B.反应③的平衡常K=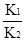
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
参考答案:B
本题解析:
在书写平衡常数表达式时,纯固体不能表示在平衡常数表达式中,A错误;由于反应③=反应①-反应②,因此平衡常数K=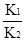 ,B正确;反应③中,温度升高,H2浓度减小,则平衡左移,即逆反应为吸热反应,正反应为放热反应,因此ΔH<0,C错误;对于反应③,在恒温恒容下,增大压强,如充入惰性气体,则平衡不移动,H2的浓度不变,D错误。答案选B。
,B正确;反应③中,温度升高,H2浓度减小,则平衡左移,即逆反应为吸热反应,正反应为放热反应,因此ΔH<0,C错误;对于反应③,在恒温恒容下,增大压强,如充入惰性气体,则平衡不移动,H2的浓度不变,D错误。答案选B。
本题难度:一般
3、填空题 将2mol H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g)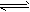 2H2+O2、2CO+O2
2H2+O2、2CO+O2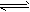 2CO2。
2CO2。
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是_____________和__________,或__________和__________。(填它们的分子式)
?(2)若平衡时O2和CO2的物质的量分别为:n平(O2)=amol,n平(CO2)=bmol。试求n平(H2O)=________
(用含a、b的代数式表示)
参考答案:(1)H2O;H2;CO;CO2
(2)(2-2a-b)mol
本题解析:
本题难度:一般
4、填空题 某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 2.00 | 0.00 |
| 1 | 0.90 | 1.80 | 0.20 |
| 3 | 0.75 | 1.50 | 0.50 |
| 5 | 0.65 | 1.30 | 0.70 |
| 9 | 0.55 | 1.10 | 0.90 |
| 10 | 0.55 | 1.10 | 0.90 |
| 14 | 0.55 | 1.10 | 0.90 |

参考答案:(1)X+ 2Y 2Z (2)0.017 mol/(L.min)(3)45%?
2Z (2)0.017 mol/(L.min)(3)45%?
(4)升高温度;使用合适催化剂;增大压强
本题解析:(1)在0~1min时,XY分别减少了0.1mol和0.2mol,而Z增加了0.2mol,所以根据反应速率之比是相应的化学计量数之比可知,方程式为X+ 2Y 2Z。
2Z。
(2)在0~3 min内,Z增加了0.5mol,所以Z的反应速率是 。
。
(3)平衡时X的物质的量是0.55mol,则消耗X是0.45mol,所以X的转化率是
(4)根据图像可知,曲线1中平衡时Z是0.6mol,和表中的数据相比,Z的物质的量减少。由于正反应是放热反应,所以曲线1的条件是升高温度;曲线2中平衡时Z的物质的量仍然是0.9mol,但达到平衡的时间少,因此改变的条件是使用了合适的催化剂;曲线3中平衡时Z的物质的量增加,且达到平衡的时间少,由于正反应是体积减小的,因此改变的条件是增大压强。
本题难度:一般
5、选择题 反应N2(g)+3H2(g) 2NH3(g)在密闭容器中进行。分别用N2、H2、NH3三种物质在单位时间内浓度的变化表示该反应的速率为V(N2)、V(H2)、V(NH3),则三者之间的关系正确的是
2NH3(g)在密闭容器中进行。分别用N2、H2、NH3三种物质在单位时间内浓度的变化表示该反应的速率为V(N2)、V(H2)、V(NH3),则三者之间的关系正确的是
[? ]
A.V(N2)=V(NH3)
B.3v(H2)=2v(NH3)
C.v(NH3)=2/3v(H2)
D.v(H2)=3v(N2)
参考答案:CD
本题解析:
本题难度:简单