时间:2025-06-26 02:17:55
1、选择题 某同学按右图所示的装置进行试验。A、B 为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42一从右向左移动。下列分析错误的是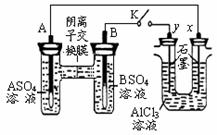
A.金属活动性A强于B
B.B电极反应B-2e-=B2+
C.x电极上有H2产生,发生还原反应?
D.反应初期x电极周围出现白色沉淀,继续实验沉淀将溶解
参考答案:B
本题解析:交换膜处 SO42一从右向左移动,说明A电极是负极,B电极是正极,即A的金属性强于B的金属性,选项A正确;正极得到电子,发生还原反应,选项B不正确;x电极和电源的负极相连,作阴极溶液中的氢离子放电生成氢气,C正确;y电极是阳极,溶液中的氯离子放电生成氯气。由于氢离子发生破坏水的电离平衡,溶液显碱性,因此有氢氧化铝白色沉淀产生。由于氢氧化铝是两性氢氧化物,所以随着溶液碱性的增强,氢氧化铝又溶解,D正确,答案选B。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断和计算。而在判断电解产物时,首先判断阳极电极材料。如果是活性电极,则电极本身失去电子。如果是惰性电极,则溶液中的阴离子失去电子。而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序。
本题难度:一般
2、选择题 钢铁在锈蚀过程中,下列5种变化可能发生的是(?)
a.Fe由+2价转化为+3价;b.O2被还原;c.产生H2;d.Fe(OH)3失水生成Fe2O3·H2O;e.杂质C被氧化除去
A.ab
B.cd
C.abcd
D.abcde
参考答案:C
本题解析:钢铁腐蚀过程中发生的变化为单质铁由0价到+2价,还可以继续氧化由2价转化为3价;酸性条件下可以发生析氢腐蚀,生成的Fe(OH)3失水生成Fe2O3·H2O。
本题难度:一般
3、选择题 下列说法正确的是
[? ]
A.铅蓄电池放电时铅电极发生还原反应
B.电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C.给铁钉镀铜可采用CuSO4作电镀液
D.生铁浸泡在食盐水中发生析氢腐蚀
参考答案:C
本题解析:
本题难度:一般
4、填空题 炒过菜的铁锅未及时洗净,在空气中不久便会因腐蚀而出现红褐色锈斑。请回答:?
(1)铁锅的锈蚀是______腐蚀(填“析氧"或“吸氧”?) ?
(2)写出铁锅腐蚀时负极的电极反应式______________
(3)写出铁锅在中性条件下正极的电极反应式________________
参考答案:(1)吸氧?
(2)Fe-2e-===Fe2+?
(3)2H2O+O2+4e-==4OH-
本题解析:
本题难度:一般
5、选择题 为了防止钢铁锈蚀,下列防护方法中正确的是
[? ]
A.在精密机床的铁床上安装铜螺钉
B.在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中
C.在海轮舷上用铁丝系住锌板浸在海水里
D.在地下输油的铸铁管上接直流电源的负极
参考答案:CD
本题解析:
本题难度:简单