时间:2025-06-26 02:17:55
1、填空题 某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及 电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如下图所示,回答下列问题:
电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如下图所示,回答下列问题: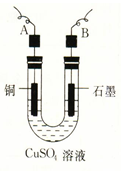
(1)该装置中B电极为电解池的?极(填“阴”或“阳”);
(2)A电极上的电极反应式为?;
电解池总反应的离子方程式为?;
(3)电解过程中,电解质溶液的酸性?(填“增强”、“减弱”或“不变”);
(4)下列实验操作中必要的是?(填写字母);
A.称量电解前的电极的质量;
B.电解后,电极在烘干称量前,必须用蒸馏水冲洗;
C.刮下电解后电极上析出的铜,并清洗,称量;
D.电解后烘干称重的操作中必须按“烘干→称量 →再烘干→再称量”进行;
→再烘干→再称量”进行;
(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为?(用带有m、V的计算式表示)。
参考答案:
本题解析:略
本题难度:一般
2、选择题 下列有关金属腐蚀与防护的说法正确的是
[? ]
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
参考答案:AC
本题解析:
本题难度:简单
3、填空题 (12分)研究钢铁的腐蚀与防护具有非常重要的意义。
(1)铁的电化学腐蚀包括两种,这两种腐蚀的负极反应均为?,而正极反应由铁表面的水膜酸碱性决定,当水膜酸度较高时,正极反应式为?,这种腐蚀称为?腐蚀,而水膜酸性不强时,正极反应式为?,这种腐蚀称为?腐蚀。
(2)防止钢铁腐蚀的电化学方法有两种,下图中液体为海水,请在图中添加必要的导线、电源,注明另一电极的电极材料名称,使其符合图下所注的保护方法: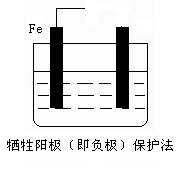 ?
?
参考答案:(1)(电极反应式每个2分,其他每个1分)
Fe -2e– =Fe2+?2H++ 2e– = H2↑?析氢?O2+2H2O+ 4e– =4OH–?吸氧
(2)(毎图2分)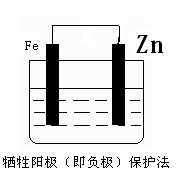 ?
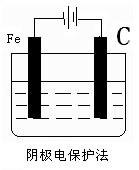
?
本题解析:考查金属的腐蚀与防护
(1)金属发生电化学腐蚀,金属均是失去电子,作负极,反应式是Fe -2e– =Fe2+ 。当水膜酸度较高时,发生析氢腐蚀,正极反应式为2H++ 2e– = H2↑;而水膜酸性不强时,则发生吸氧腐蚀,正极反应式为O2+2H2O+ 4e– =4OH–。
(2)电化学防止金属腐蚀的方法有两种,分别是牺牲阳极的阴极保护法和外加电流的阴极保护法。因此左图中需要一种金属性强于铁的,例如锌;而右图中铁应该作阴极,和电源的负极相连,所以正确的图示是 ?
?
本题难度:一般
4、选择题 铁钉与炭棒用导线连接后,同时浸入0.01mol/LNaCl的溶液中,可能发生的反应是(?)
A.炭棒上放出氯气
B.炭棒附近产生OH-
C.炭棒上放出氧气
D.铁钉被氧化
参考答案:BD
本题解析:铁钉与炭棒用导线连接后同时浸入0.01mol/LNaCl的溶液中形成原电池,易发生电化学腐蚀,在中性的条件下,发生吸氧腐蚀。即:负极Fe —2e-=Fe2+, 铁被氧化;正极2H2O + O2 + 4e-==4OH-,产生OH-。
本题难度:简单
5、填空题 (10分)电解原理和原电池原理是电化学的两个重要内容。某兴趣小组做如下探究实验: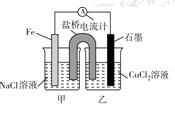
Ⅰ.(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示)_______________________________设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________________________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因____________________________________________。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨(1)为________极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为_________________________________。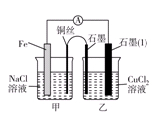
Ⅱ.如右图所示装置,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL。
请完成下列问题: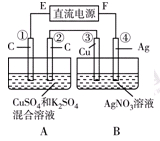
①第②极上生成的物质为________mol。
②写出第①极上发生反应的电极反应式_________________________。
③设A池中原混合液的体积为200 mL,则通电前A池原混合液中Cu2+的浓度为________ mol/L。
参考答案:Ⅰ.(1)Fe+Cu2+=Fe2++Cu ? 0.2
(2)2H++2e-=H2↑? 酸性? NH4++H2O NH3·H2O+H+
NH3·H2O+H+
(3) 阴? 2Cl--2e-=Cl2↑
Ⅱ.(1)①0.005? ②Cu2++2e-=Cu 2H++2e-=H2↑(共1分) ?③0.025
本题解析:Ⅰ.由图可知该装置为原电池,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差12g,
则Fe+Cu2+═Fe2++Cu?两极质量差△m?转移电子
56g? 64g? 56g+64g=120g? 2mol
12g? n
n=0.2mol
(2)若将CuCl2溶液换为NH4Cl溶液,溶液呈酸性,发生:NH4++H2O?NH3?H2O+H+,负极发生2H++2e-═H2↑,负极发生Fe-2e-=Fe2-。
(3)将盐桥换成弯铜导线与石墨相连成n型,则甲装置为原电池,铁做负极,铜为正极。乙装置为电解池,石墨(1)为阴极,乙装置中与铜线相连石墨电极为阳极。发生的反应式为2Cl--2e-=Cl2↑
Ⅱ.由图可知,B装置为电解池,第③极增重2.16g,发生Ag++e-=Ag,n(Ag)=0.02mol,则转移电子为0.02mol,
A池中收集到标准状况下的气体224mL,所以气体的物质的量为0.224L/22.4L/mol=0.01mol,
A装置中阳极发生4OH--4e-=O2↑+2H2O,转移0.02mol电子。第②极生成气体为0.005mol,
所以第①极上发生反应的电极反应式为
2H++2e-=H2↑,
0.01?0.005
Cu2++2e-=Cu
0.005 0.01
即Cu2+的物质的量为(0.02?0.005×2)/ 2=0.005mol,
c(Cu2+)=0.005mo/l0.2L=0.025mol/L。
本题难度:一般